La práctica regular de ejercicio físico y el cumplimiento de unas pautas alimentarias saludables aportan indiscutibles beneficios para la salud de las poblaciones, incluyendo el efecto preventivo sobre diferentes patologías crónicas como el cáncer, la enfermedad cardiovascular y la diabetes1-4. Paradójicamente, durante la última década, tanto el ejercicio físico como determinados modelos dietéticos han sido ampliamente estudiados como importantes inductores de estrés oxidativo.
La inducción de estrés oxidativo durante el ejercicio físico se ha propuesto como una causa de daño a nivel de la membrana del miocito, lo que conduce a una exacerbada respuesta inflamatoria5,6, y por consiguiente al padecimiento de excesivo dolor y fatiga muscular posterior es al ejercicio7,8. Sin embargo, en la literatura actual existen evidentes discrepancias, tanto en la propia presencia de estrés oxidativo asociado a diferentes esfuerzos, como en los fenómenos adaptativos que podrían resultar si este desequilibrio persiste durante un período determinado. Posiblemente, los principales condicionantes de estas discrepancias son la elevada reactividad y la corta vida media de los radicales libres (FR)9, los errores en los sistemas de muestreo de material biológico susceptible al análisis10 y las propias diferencias metodológicas en cada protocolo de estudio (edad y sexo de los sujetos estudiados, la intensidad, la regularidad de la práctica del ejercicio y la modalidad de éste). Además, otras variables asociadas al ejercicio, como la dieta previa y las propias condiciones climáticas bajo las que se realiza, han sido poco estudiadas en relación con su efecto sobre la producción de FR11. En consecuencia, la verdadera relevancia fisiopatológica del estrés oxidativo inducido por el ejercicio y sus condiciones de práctica son aún confusas y requieren una revisión exhaustiva.
Estudios recientes han propuesto que la producción de especies reactivas del oxígeno (ROS), e incluso la propia presencia de estrés oxidativo inducido por el ejercicio ejercen un papel relevante en la efectividad de la contracción muscular12, favoreciendo, además, la remodelación de tejidos y constituyendo un estímulo natural que conduce a una mejora de las defensas antioxidantes13,14 y a un descenso en la activación de la vías inflamatorias15, lo que se traduce en una mayor resistencia de los organismos a la toxicidad de los FR16.
El presente artículo tiene como objetivo realizar una revisión sobre la presencia de estrés oxidativo en relación con el ejercicio físico, intentando ayudar a la clarificación de su papel y del posible efecto que tienen sobre él diferentes acciones complementarias, como la dieta y el medio ambiente en el cual se entrena. Asimismo, pretende analizar de forma crítica las recientes evidencias experimentales sobre los principales efectos biológicos del estrés oxidativo, tanto negativos como positivos para la salud del deportista.
Estrés oxidativoEl estrés oxidativo ha sido clásicamente definido como el desequilibrio entre los mecanismos fisiológicos responsables de la producción y la neutralización de compuestos reactivos capaces de causar un daño molecular oxidativo. Más recientemente Jones17 definió el estrés oxidativo como “el desequilibrio entre oxidantes y antioxidantes, en favor de los primeros, que conduce a una ruptura del control y señalización fisiológica que normalmente ejerce el sistema redox, conduciendo a un daño molecular”. Aunque esta definición considera el daño molecular como la condición fundamental para hablar de un verdadero desequilibrio o estrés oxidativo, también deja claro que los compuestos oxidantes y antioxidantes del sistema redox desempeñan un papel de gran importancia en la fisiología normal de los sistemas biológicos. Por otra parte esta definición, aparentemente sencilla, implica un concepto amplio que aún continúa siendo difícil de entender en la práctica habitual, y que genera dificultades en la implementación de medidas específicas.
Radicales libres y especies reactivas del oxígenoLa estabilidad de una molécula es alcanzada cuando los electrones dispuestos en su último orbital se encuentran en forma apareada. Por el contrario, cuando un átomo o molécula gana o pierde un electrón por diferentes circunstancias físicas o químicas, ésta se vuelve altamente inestable y se denomina FR. Así, un FR se puede definir como una especie química, neutra o cargada, cuya capa periférica contiene uno o más electrones desapareados18, situación que le confiere gran inestabilidad desde el punto de vista cinético y energético19. Aunque su vida media es realmente corta, desde milisegundos a nanosegundos, en cada reacción de oxidación con otro átomo o molécula, un FR puede generar nuevas formas con diferente nivel de estabilidad y toxicidad.
En los organismos de metabolismo aeróbico las especies reactivas de mayor importancia, son aquéllas que se forman durante el metabolismo del oxígeno, y se denominan ROS. Es importante considerar que el término ROS incluye una variedad de FR propiamente dichos y otros átomos o moléculas que no son FR, pero que se consideran ROS por su alta reactividad en el medio que les confiere la capacidad de generar ROS, como es el caso del peróxido de hidrógeno (H2O2)18,20. Además, existen otras familias derivadas del nitrógeno (especies reactivas del nitrógeno [RNS]), del azufre (especies reactivas del azufre) o del cloro (especies reactivas del cloro) (tabla 1) que pueden o ser originadas por la interacción del átomo o molécula con algunas ROS o incrementar la producción de estas últimas21.
Tabla 1. Clasificación y abreviatura de los radicales libres
Formación de especies reactivas del oxígenoLa formación de la FR está directamente relacionada con los fenómenos de óxido-reducción. A continuación se describen los dos mecanismos fundamentales de formación:
1) A partir de la adición o la pérdida de un electrón de la última capa de la molécula: A ± e-= A.
2) A partir de la ruptura de una molécula estable, formada por dos fragmentos en forma equilibrada: A – B= A. + B.
En los organismos aeróbicos la oxidación de sustratos energéticos, así como diferentes reacciones enzimáticas, implican una formación endógena continua de ROS. Entre las ROS más comunes es necesario hablar de:
Anión superóxidoEl anión superóxido (O2 .-) es creado por la adición de un electrón a la molécula de oxígeno, resultando en una especie altamente reactiva capaz de provocar oxidación lipídica, peroxidación y daño al ADN:
O2 + e-= O2 . -
Las moléculas de O2 .- pueden sufrir un proceso de dismutación (óxido-reducción) en presencia de iones de H+ determinando la formación de oxígeno y H2O2:
O2 .- + O2 .- 2H+ -> H2O2 + O2
La coexistencia de O2 .- y H2O2 determina la formación del radical hidroxilo (OH.) a través de la denominada reacción de Haber Weiss22:
H2O2 + O2 . - = OH- + O2 + OH.
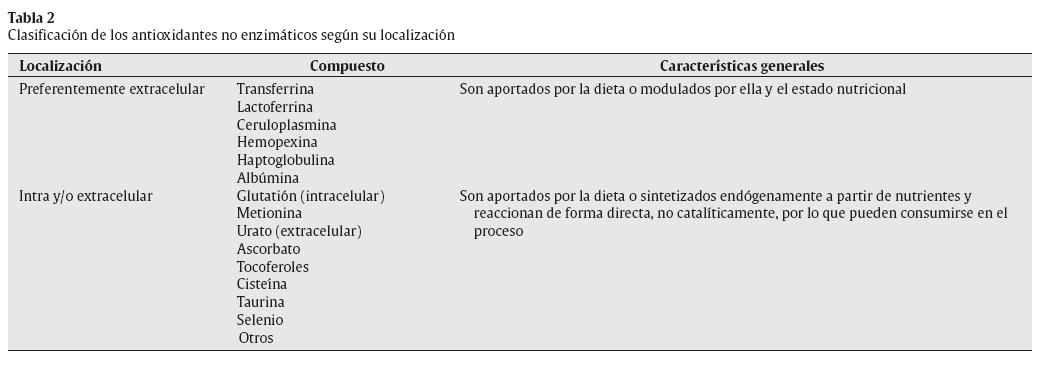
El -> O2 •- posee una carga negativa, y comparado con otros FR tiene una vida media relativamente mayor, lo que le permite difundir dentro de la célula e incrementar el número de potenciales dianas oxidativas12. Además, algunas moléculas de O2 •- pueden proceder directamente de la reacción del oxígeno con compuestos como las catecolaminas, o a través de las reacciones inmunitarias de fagocitosis23,24 (fig. 1). La siguiente ecuación muestra la formación de O2 .- durante la activación fagocítica:
2O2 + NADPH NADPH-oxidasa -> 2O2 . - + NADPH+ + H+
Fig. 1. Fuentes de O2•-.
Peróxido de hidrógenoEl H2O2 es un compuesto no radical perteneciente al grupo de las ROS debido a que puede generar fácilmente otros FR e inducir reacciones oxidativas en cadena. En reacciones catalizadas por metales, como la reacción de Fenton25, el H2O2 se descompone en un ión OH-, que es inofensivo, y un radical OH•, el más reactivo y tóxico de las ROS, capaz de atacar estructuras orgánicas estables como los fosfolípidos de membrana, colesterol y proteínas.
Reacción de Fenton:
Fe3+ O2 .- = Fe2+ + O2
Fe2+ + H2O2 = Fe3+ + OH- + OH.
Radical hidroxiloEl OH•, aunque no tiene la capacidad de difundir a través de las membranas celulares, posee un alto poder oxidante capaz de provocar peroxidación lipídica y daño oxidativo a las proteínas26. Debido a su alta reactividad ocasiona daño molecular en el propio sitio donde se genera.
Oxígeno singuleteEl oxígeno singulete (1O2) es una forma no radical que, a pesar de su corta vida media, tiene la capacidad de difundir a través de la membrana y participar en diferentes reacciones en las que actúa con el oxígeno molecular27. La dismutación del O2 •- en agua puede producir también 1O2. Este compuesto es potencialmente oxidante para los lípidos de membrana, pero aún no se ha demostrado que la contracción muscular durante el ejercicio físico incremente su producción12.
Óxido nítricoEl NO es sintetizado por un grupo de enzimas específicas denominadas óxido nítrico sintetasas (NOS) a partir del aminoácido L-arginina. Las NOS convierten la L-arginina en NO y L-citrulina utilizando NADPH. Esta familia de enzimas se expresan de forma diferencial en múltiples tejidos y pueden clasificarse en: a) neuronal (NOS1), principalmente en células neuronales pero también en otros tejidos; b) inducible (NOS2) predominante en condiciones inflamatorias y c) endotelial (NOS3) expresada en células del endotelio vascular. En el NO tiene un papel fundamental la célula por su habilidad para activar la enzima guanil ciclasa, resultando en la formación de cGMP28. Desde un punto de vista redox, la síntesis excesiva de NO se asocia a estrés nitrosativo y a condiciones inflamatorias y neurodegenerativas (desmielinización, daño neuronal y pérdida oligodendrítica)29,30 a causa de su capacidad para reaccionar rápidamente con el O2 •- y producir ONOO- y con el oxígeno para formar NO2 •31. Sin embargo, este potencial nitrosativo que deriva de su capacidad para formar RNS, ha sido contrastado por diferentes estudios que muestran al NO como un compuesto antioxidante y neuroprotector32,33. En este sentido el S-nitrosoglutatión (GSNO) constituye una importante pero limitada fuente de NO, cuya función principal es la de actuar como un segundo mensajero, que regula a través de la S-nitrosilación la expresión y/o actividad de ciertas proteínas como NF-kappaB29,34. Además, una cantidad limitada de NO promueve la vasodilatación y atenúa el daño endotelial bajo condiciones de isquemia35.
PeroxinitritoLa reacción del NO con el O2 •- para producir ONOO- ocurre aproximadamente tres veces más rápido que la dismutación del O2 •- para producir H2O2
O2 . - + NO = ONOO-
El ONOO- es un agente altamente oxidante, capaz de provocar daños al ADN y la nitración de las proteínas24. Además, una formación excesiva de este compuesto conduce no sólo a la depleción de grupos tioles, sino también a una reducción en la biodisponibilidad del NO.
Sistemas antioxidantesUn antioxidante puede ser definido como un átomo o molécula que evita o bloquea las especies reactivas y el daño oxidativo, ya sea al interactuar directamente con el oxidante formando un radical menos activo, o al interferir en la cadena de reacciones oxidativas que conducen al daño de los sustratos, tales como lípidos, proteínas, carbohidratos o el ADN36. Una definición más amplia incluye también aquellas moléculas encargadas de reparar el daño oxidativo provocado por las especies reactivas.
Los diferentes compuestos antioxidantes pueden ser de origen endógeno (sintetizados por el organismo) o exógeno (provistos a través de la dieta).
Además, todos los antioxidantes pueden ser agrupados de acuerdo a su naturaleza en enzimáticos y no enzimáticos.
Antioxidantes enzimáticosLa mayoría de las células poseen una batería de enzimas que desechan las ROS. Este sistema antioxidante enzimático es modulado por varios factores, entre los que el ejercicio físico desempeña un importante papel, como ha sido demostrado en diferentes estudios37,38. Las enzimas antioxidantes incluyen la superóxido dismutasa (SOD), la catalasa (CAT) y la glutatión peroxidasa (GPx).
La SOD posee dos isoformas clasificadas según el ión metálico ligado a su sitio activo (cobre-zinc o manganeso)39. Así la Cu/Zn SOD se encuentra fundamentalmente a nivel nuclear, citoplasmático y vascular, siendo codificada en el cromosoma 21. La Mn SOD se halla en la matriz mitocondrial, siendo termoestable y codificada en el genoma nuclear. Ambas isoformas tienen similar eficiencia catalizando la dismutación del O2 •- para formar H2O2 y O2, según la siguiente ecuación:
2O2 . - + 2 H+ SOD ->H2O2 + O2
La CAT es una hemoproteína de 4 subunidades que se encuentra en mayor concentración en los peroxisomas que a nivel mitocondrial. Su principal función consiste en convertir el H2O2, producido por betaoxidación de ácidos grasos en los peroxisomas, en H2O y O2, como se muestra a continuación:
H2O2 CAT ->2 H2O + O2
La GPx es una enzima constituida por 4 subunidades selenio-cisteína, codificada por el triplete UAG (adenosina-uridina-guanosina), que se encuentra localizada a nivel del citosol, la mitocondria y la membrana celular. Se han identificado 5 isoformas de la GPx en mamíferos40; todas ellas catalizan la reducción del H2O2 en H2O y de hidroperóxidos (ROOH) en H2O y alcohol (ROH). En su reacción antioxidante utiliza glutatión reducido (GSH) y lo transforma en glutatión oxidado (GSSG), tal como se muestra en las siguientes ecuaciones:
H2O2 + 2 GSH GPx -> GSSG + 2 H2O
2 GSH + ROOH -> GSSG + ROH + H2O
Si bien la GPx y la CAT poseen una redundancia en su función para eliminar el H2O2, las diferencias en su afinidad para con este compuesto determinan que la primera sea más eficiente con bajas concentraciones de H2O2, mientras que la CAT lo es con altas concentraciones de H2O2 41. Las enzimas SOD, CAT y GPx, junto con otros compuestos no enzimáticos, como la ferritina, lactoferrina y ceruloplasmina, constituyen el primer nivel de defensa antioxidante.
Por otro lado, al nivel del citoplasma existen dos sistemas enzimáticos de relevancia en el mantenimiento del equilibrio redox de las células: son el sistema de las tiorredoxinas y de las glutarredoxinas42. Específicamente las tiorredoxinas forman un potente sistema antioxidante independiente que permitiría a las células sobrevivir incluso en condiciones en las que el sistema glutation/glutarredoxinas fuera oxidado43; además las tiorredoxinas también modulan diferentes procesos celulares, incluyendo la síntesis de deoxirribonucleótidos y la reparación del daño oxidativo a las proteínas44.
Antioxidantes no enzimáticosExiste una variedad de compuestos antioxidantes de naturaleza no enzimática que pueden actuar a nivel intracelular, extracelular o en ambos compartimentos (tabla 2).
Tabla 2 Clasificación de los antioxidantes no enzimáticos según su localización
Entre los antioxidantes intracelulares el GSH es un compuesto peptídico de la familia de los tioles, que tiene un papel fundamental en la defensa antioxidante del miocito, y por lo tanto es de gran interés en relación con el ejercicio. Además del reciclaje intracelular de GSH a partir del GSGG formado por acción de la GPx, el GSH es sintetizado ex novo en el hígado y transportado posteriormente hacia los tejidos a través de la circulación sanguínea. Su concentración celular es dependiente de la actividad metabólica del tejido45 y su importancia se debe a que actúa de tres formas: a) reaccionando directamente con diferentes FR como un dador de electrones; b) sirviendo como sustrato para la GPx en su reacción antioxidante y c) reduciendo las formas oxidadas, y por lo tanto reciclando el poder antioxidante de otros compuestos como las vitaminas C y E. Diferentes estudios han mostrado que el contenido muscular de GSH se incrementa en respuesta a la práctica regular de ejercicios de resistencia de alta intensidad (> 80% VO2máx)46,47.
Estrés oxidativo y ejercicio físico Formación de ROS y ejercicio físicoLa idea clásica que propone la hiperractividad mitocondrial como la principal fuente de ROS durante el ejercicio, ha sido progresivamente sustituida en las últimas décadas por una teoría más amplia, que considera la participación de diferentes fuentes metabólicas de ROS48. El hecho de que la producción de ROS no es estrictamente proporcional al consumo de oxígeno durante el ejercicio, tal como fue descrito en condiciones de reposo, evidencia la participación de otras fuentes de generación de ROS, como los fenómenos de isquemia reperfusión, las reacciones enzimáticas e inmunitarias, la autoxidación de catecolaminas, la producción de ácido láctico, etc. Además, las características del propio ejercicio (por ejemplo la intensidad, la duración, el tipo de contracción muscular), así como las condiciones ambientales en las que se entrena (dieta, temperatura, presión de oxígeno, etc.) podrían potenciar la actividad de estas fuentes de generación de ROS y determinar un fallo o insuficiencia de los mecanismos capaces de contrarrestar su formación, conduciendo a un daño molecular y estrés oxidativo.
Aunque todas las fuentes de formación de ROS durante el ejercicio se consideran como fisiológicas, podrían clasificarse según su capacidad de regulación o “previsión” por parte de los sistemas de homeostasis del organismo en:
1) Formación regulada de ROS: en ella se incluye específicamente el sistema inmune que posee una necesidad fisiológica de ROS. La formación regulada de un ambiente oxidativo es una condición esencial para que los macrófagos y neutrófilos puedan desarrollar su metabolismo normal y realizar la eliminación de antígenos y células apoptóticas49. Desde el punto de vista bioquímico, dos moléculas de oxígeno en presencia de NADPH-oxidasa producen dos moléculas de O2 •- en la reacción llamada “estallido oxidativo”50. El objetivo final de esta reacción es la formación de H2O2 a través de la reacción de Fenton en presencia de SOD51. Aunque su estructura no permite calificarlo como un FR, el H2O2 es considerado entre las ROS debido a su capacidad para generar otros FR. En los leucocitos la mieloperoxidasa produce, a partir H2O2, un potente ácido antimicrobiano denominado ácido hipocloroso, que además es un fuerte agente oxidante52.
2) Formación no regulada de ROS: es decir, aquélla que se produce espontáneamente y de una forma dosis-dependiente a los estímulos que la activan, como ocurre con los factores ambientales como el ejercicio físico, la dieta, la temperatura ambiental, las radiaciones, etc. Específicamente en el caso del ejercicio esta producción de ROS fluctúa de acuerdo a las necesidades de energía, nivel de estrés al que se somete el organismo, temperatura central y otros fenómenos que pueden conducir a estrés oxidativo37.
Formación de ROS durante el metabolismo aeróbicoLa necesidad de ATP para un ejercicio de baja o moderada intensidad es fundamentalmente cubierta a través de la fosforilación oxidativa. La cadena de transporte de electrones (CTE) es el proceso clave del metabolismo aeróbico, que ocurre dentro de la mitocondria y conduce a la generación primaria de energía y secundaria de ROS53. Al finalizar la oxidación de sustratos en el ciclo de Krebs se produce la formación de moléculas reducidas (NADH y FADH), que posteriormente intervienen en el transporte de electrones a través de la cadena, generando suficiente energía para producir ATP desde ADP y Pi, según complejos mecanismos explicados en la llamada hipótesis quimiostática54. El oxígeno es clave en este proceso, al actuar como un aceptor de electrones al final de la cadena de transporte de los mismos, lo cual permite la continuidad del sistema energético. Sin embargo, a este nivel, además de la formación de moléculas de agua, aproximadamente entre 1-5% de las moléculas de oxígeno diatómico (O2) son activadas formando O2 •- a causa de la incorporación de un electrón. La producción de O2 •- es por lo tanto proporcional a la actividad de la CTE, siendo importante aclarar que esta última no necesariamente es proporcional al consumo de oxígeno en el humano55.
La CTE contiene además varios centros redox (como los complejos I, II y III) que pueden agregar electrones a las moléculas de O2 constituyendo fuentes primarias de O2 •-53 (fig. 2). El O2 •- producido a nivel de la CTE puede reducir al citocromo C (en el espacio intermembrana) o ser convertido en H2O2 y O2 (en la matriz o espacio intermembrana). Si la actividad mitocondrial es incrementada y mantenida en el tiempo (como puede ocurrir con el ejercicio físico), se puede constituir un estado estable de generación de O2 •-, que puede reducir metales de transición (favoreciendo la formación de OH•) o reaccionar con el NO para formar ONOO- 56. Sin embargo, la liberación de ROS fuera de la mitocondria dependería de factores como el potencial de membrana de la misma. En este sentido, diferentes estudios coinciden en que la liberación de ROS ocurre principalmente cuando es alcanzado un potencial máximo (estado IV) de la membrana mitocondrial57,58.
Fig. 2. Sitios de formación de O2•- en la cadena de transporte de electrones.
Formación de ROS durante el metabolismo anaeróbicoEn ejercicios intensos y de corta duración, es decir, con un metabolismo energético predominantemente anaeróbico (como aceleraciones y ejercicios isométricos), la redistribución del flujo sanguíneo hacia el músculo en contracción y hacia los tejidos prioritarios, como el corazón y el cerebro, determina que otros órganos como los riñones, el bazo e incluso el hígado, sean sometidos a periodos de hipoxia59. Sin embargo, al finalizar la contracción muscular, los tejidos hipóxicos vuelven a recibir el flujo sanguíneo de forma brusca, y por consiguiente reciben una gran cantidad de oxígeno. Este fenómeno conocido como “isquemia-reperfusión” es, en importancia, la segunda fuente de producción de ROS inducida por el ejercicio60. La activación del sistema xantino-oxidasa (XO) en los tejidos reperfundidos, cataliza la formación de O2 •- en presencia de oxígeno, hipoxantina y xantina como sustratos para la reacción61. En los tejidos no hipóxicos este sistema enzimático se encuentra en la forma de xantino-deshidrogenasa (XD), principalmente involucrado en la formación de ácido úrico, pero puede fácilmente ser convertido a XO durante la isquemia-reperfusión48. El fenómeno de isquemia-reperfusión puede ocurrir también en algunas situaciones patológicas, como es el caso de intervenciones quirúrgicas, estados de choque y en menor medida durante la apnea del sueño62.
Incremento de la temperatura central, lactato y catecolaminasSe ha demostrado que el incremento de la temperatura central durante el ejercicio físico, a causa de ambiente caluroso y/o una inadecuada reposición hídrica, diminuye el rendimiento deportivo como resultado de la incapacidad del sistema cardiovascular para mantener un gasto cardíaco efectivo63. Esto se traduce en un deterioro de diferentes variables fisiológicas y en una reducción de la capacidad aeróbica para producir energía, lo que incrementa la secreción adrenérgica y la producción de lactato como consecuencia de una mayor utilización de la vía glucolítica anaeróbica64. En este sentido, una mayor secreción de adrenalina no sólo incrementa la actividad mitocondrial a partir de la activación de receptores β-adrenérgicos, sino que también favorece los procesos de autooxidación de la adrenalina a adrenocromo, conduciendo a un incremento en la producción de O2 •- 65,66; este mecanismo ha sido implicado incluso en el daño cardíaco posisquemia67. Por otra parte, diferentes estudios in vitro han demostrado que el lactato por sí mismo puede incrementar la producción de O2 •- mediante la activación de la NADH oxidasa, y por reducción directa del pH de la célula68,69. La relación de estos fenómenos con el desequilibrio redox en condiciones ambientales de calor ha sido reforzada recientemente por McAnulty et al70, quienes hallaron una mayor concentración de F2-isoprostanos en plasma (indicador de la peroxidación lipídica) en un grupo de individuos sanos que se ejercitaron aeróbicamente (50% VO2máx) en condiciones de calor hasta alcanzar una temperatura central de 39,5° C, comparado con un grupo control que se ejercitó en un ambiente térmicamente neutro. Estos autores también observaron una significativa acumulación del lactato sanguíneo en el grupo que se entrenó en condiciones de calor, reforzando la evidencia experimental que vincula el estrés metabólico durante el ejercicio con la ocurrencia de estrés oxidativo.
Oxidación de la hemoglobina y mioglobinaEl incremento de la autooxidación normal de hemoglobina (aproximadamente 3% o menos) conduciría durante el ejercicio físico a la formación de metahemoglobina y de O2 •-71. Por su parte, la mioglobina, asociada al transporte del O2 y a la defensa antioxidante del miocardio72, también puede zexperimentar fenómenos de autooxidación a metmioglobina, siendo otra fuente importante de ROS que se ha relacionado incluso con el daño oxidativo del miocardio durante la isquemia-reperfusión73. Tanto la isquemia-reperfusión como los fenómenos de hipoxia estarían directamente relacionados con la autooxidación de la mioglobina y la hemoglobina debido al incremento de NADH, a la producción de H2O2 y a la acidificación del medio celular74,75.
Hipoxia y ROSEn términos químicos las reacciones redox no se encuentran siempre en equilibrio, por lo tanto una molécula o compuesto puede ser un oxidante en una reacción, o un reductacte en otra reacción producida en el mismo medio. La hipoxia celular implica un estado que se caracteriza por una incrementada formación de equivalentes reducidos (principalmente NADH y FADH) debido a la insuficiente disponibilidad de O2 para ser reducido en la CTE a nivel mitocondrial76. Estos equivalentes reducidos también incrementan la disponibilidad de electrones para generar reacciones reductivas, tales como la reducción del O2 a O2 •- (un ROS, pero también un moderado reductante). El término “estrés reductivo” ha sido usado para describir el ambiente intracelular reductivo causado por una hipoxia que conduce a la formación de ROS y RNS en cantidad suficiente para dañar las estructuras biológicas77.
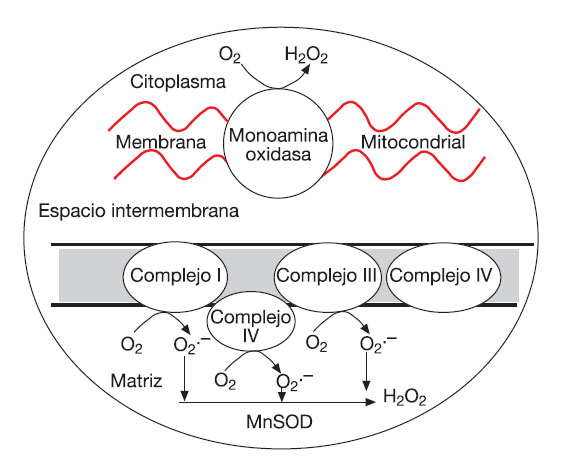
Es importante considerar que la actividad de enzimas como la ciclooxigenasa, NAD(P)H oxidasa y XO, junto con cierta disponibilidad de O2 (como sustrato) son fundamentales para la formación de las ROS en condiciones de hipoxia76, por lo que las situaciones que implican una baja disponibilidad de oxígeno (como exposición a las condiciones de altitud con o sin ejercicio), o los períodos intermitentes de isquemia generados por el ejercicio pueden favorecer el desequilibrio redox62,78 (fig. 3). En relación con el ejercicio en altitud, tanto en modelos animales79 como en humanos78,80,81 expuestos a altitud extrema (entre 3.000 y 8.500 metros) la biopsia muscular ha demostrado la ocurrencia de daño y de estrés oxidativo a través de un incremento en la peroxidación lipídica, oxidación de proteínas y daño oxidativo del ADN muscular. En condiciones de ejercicio sin exposición a la altitud, los períodos intermitentes de anoxia-reoxigenación del tejido muscular (isquemia-reperfusión) p ser considerados como la fuente de hipoxia celular más frecuente en el humano. Bailey et al82 demostraron recientemente la importancia de la presión parcial del O2 (PO2) en el músculo sobre la generación de ROS, radicales alcoxi y peroxi cuando un grupo de sujetos fueron sometidos a un ejercicio de extensión de rodilla con una intensidad incremental (25, 70 y 100% de la fuerza máxima). Estos autores también hallaron un incremento en la liberación de otros compuestos relacionados con el desequilibrio redox en estas condiciones (iones de hidrógeno, catecolaminas, lactato deshidrogenasa y mioglobina).
Fig. 3. Distribución bimodal propuesta para la formación de ROS según la PO2 intracelular. ROS: especies reactivas del oxígeno. Adaptada de Clanton76.
Efectos biológicos de ROSDebido en parte a la búsqueda incesante de factores involucrados en la mejora del rendimiento deportivo y a la recuperación frente al ejercicio, se han publicado hasta la fecha una gran cantidad de estudios enfocados principalmente en investigar la relación de las ROS con la concurrencia de fatiga temprana83,84, reacción inflamatoria y dolor muscular durante la recuperación85. Sin embargo, recientes publicaciones también muestran a las ROS como compuestos esencialmente vinculados a efectos positivos en relación con la salud del deportista. El efecto antiinflamatorio asociado al ejercicio86, la biogénesis muscular a partir de mecanismos sensibles al estado redox87,88, una mejora de la restitución del glucógeno, e incluso un incremento de la contractibilidad y fuerza muscular89,90, son algunos de los efectos positivos de las señales celulares ejercidas por las ROS.
A continuación se analizarán algunos de los principales efectos biológicos de la generación de ROS a causa del ejercicio físico agudo y crónico.
ROS y ejercicio físico agudoEl tipo de ejercicio físico, con mayor o menor componente de contracción excéntrica capaz de dañar el músculo91, así como la intensidad y duración del esfuerzo y el grado de entrenamiento de los sujetos son las principales variables que determinan la sobreproducción de ROS en individuos sanos y enfermos sometidos a protocolos agudos de esfuerzo92. Tras una sesión aguda de ejercicio físico capaz de provocar estrés oxidativo se observan diferentes respuestas en los marcadores de daño molecular y de defensa antioxidante, analizadas tanto en muestras de sangre como en tejidos.
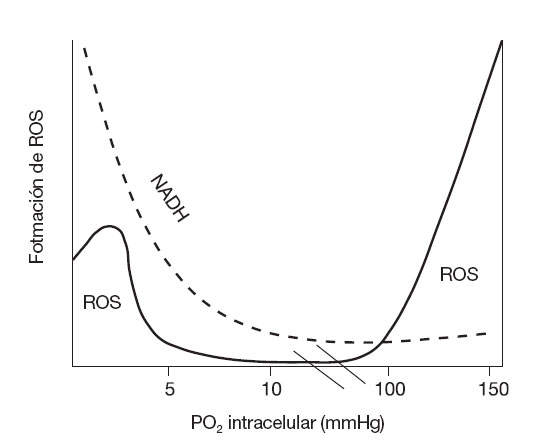
Implicaciones de ROS en la contracción muscularLa efectividad de la contracción muscular es altamente dependiente de una modesta presencia de ROS. En 1993 Reid et al propusieron que la fuerza isométrica máxima de un músculo no fatigado es alcanzada gracias a un equilibrio entre cantidades de ROS y especies reactivas de nitrógeno, junto con otras formas químicas reducidas que resultan de la acción de los sistemas antioxidantes y/o de la suplementación con antioxidantes exógenos (fig. 4)93,94. Según esta hipótesis, pequeñas cantidades de ROS son imprescindibles para la contracción isométrica95-97, e incluso un incremento muy modesto en la generación de estos compuestos puede optimizar la producción de fuerza máxima93. Por el contrario, un incremento excesivo de las ROS reduciría, en una forma dosis-dependiente, la generación de fuerza muscular isométrica95,98.
Entre las especies reactivas generadas en la célula muscular, el NO es posiblemente uno de los principales moduladores de la contracción y producción de fuerza del músculo esquelético12. Por ello, mientras que una baja producción de NO es observada en condiciones de reposo, la contracción repetida del músculo incrementa significativamente la síntesis de este compuesto99,100. La NOS3 expresada en la mitocondria del miocito y la NOS1, especialmente expresada en las fibras de contracción rápida12,101, son las principales fuentes del NO liberado durante la contracción muscular. Además, frente al uso de un inhibidor de la NOS, como el L-NAME, las propiedades contráctiles del músculo son significativamente afectadas100,102,103, lo que pone de manifiesto que ciertas cantidades de éste, y posiblemente otras ROS, son necesarias para la función muscular normal. Es posible que en las fases iniciales de un ejercicio el músculo genere ROS como un mecanismo fisiológico que le permita alcanzar un nivel de oxidantes que favorezca una contracción dinámica óptima (fig. 5). Sin embargo, en esta misma cinética, también es posible que si la duración o intensidad del ejercicio superan un umbral determinado se produzca una sobreproducción de ROS capaz de reducir la capacidad contráctil del músculo. En el caso del NO, este mecanismo podría ser fundamentado por la capacidad de este compuesto para reaccionar muy rápidamente con el O2•- y producir ONOO-, un agente oxidante capaz de provocar una depleción de los antioxidantes tiólicos, un daño del ADN e incluso nitración de proteínas. Además, una reacción secundaria de la formación de ONOO- es la reducción en la biodisponibilidad del ON, que cumple funciones clave como factor vasoactivo a nivel del endotelio.
Fig. 4. Modelo teórico sobre el efecto bifásico del estado oxidativo en la producción de fuerza muscular máxima. Adaptada de Reid MB et al93.A-1: fuerza máxima producida por un músculo no fatigado expuesto a suplementación antioxidante intensa o a la adición de agentes reductivos; A: fuerza isométrica máxima generada por un músculo no fatigado sin el agregado de oxidantes o antioxidantes; B: fuerza máxima alcanzada con un estado redox óptimo, que implica la exposición a un nivel bajo de oxidantes, pero también a compuestos reductivos; C: empeoramiento de la fuerza máxima frente a un nivel excesivo de ROS en el músculo.
Fig. 5. Modelo teórico sobre la fuerza dinámica máxima alcanzada por el músculo, según el nivel de ROS producido durante un ejercicio con duración y/o intensidad progresivas.A: Fuerza generada por un músculo no fatigado inmediatamente al iniciar un ejercicio, sin incremento de la producción muscular de ROS; B: fuerza máxima óptima, alcanzada con un nivel ideal de generación de ROS durante la contracción repetida del músculo; C: reducción de la fuerza máxima dinámica frente a una mayor generación y/o acumulación de ROS hacia el final de un ejercicio progresivo; ROS: especies reactivas del oxígeno.
ROS y fatiga muscularParadójicamente se ha demostrado que existe una relación dosis y tiempo dependiente entre la concentración de ROS y la reducción de la contractibilidad muscular y la ocurrencia de fatiga84,95. Diferentes mecanismos como la interferencia en la producción mitocondrial de energía, es decir, en la eficacia de la función mitocondrial, es la hipótesis con mayor evidencia científica para explicar la ocurrencia precoz de fatiga muscular en condiciones de estrés oxidativo84,104. Es fácil entender que el primer objetivo para el daño molecular por ROS, debido a su corta vida media, sean las estructuras moleculares cercanas al sitio de producción, como la membrana mitocondrial y por ende la propia mitocondria. Este fenómeno fuedemostrado en modelos animales donde las proteínas mitocondriales, pero no citosólicas, fueron intensamente oxidadas por la exposición aguda a OH• durante el ejercicio26. Otras estructuras posiblemente afectadas en la célula eucariota, por su vecindad a las reacciones de origen oxidativo, son el ADN mitocondrial y proteínas de membrana. Tonkonogi et al105 observaron una reducida producción de energía (menor producción de ATP por unidad de oxígeno consumido), cuando un aislado mitocondrial humano, sin suficiente defensa antioxidante, fue sometido a tratamiento con ROS. Estos mismos investigadores propusieron que el deterioro oxidativo de estructuras cercanas, como la membrana mitocondrial interior, afectaría la eficiencia bioquímica de la fosforilación oxidativa al reducir la transferencia de electrones y la formación de ATP al final de la CTE, derivando en una mayor activación de la vía anaeróbica. El redireccionamiento hacia un metabolismo anaeróbico y la modificación del estado redox favorecerían así la acumulación de fosfatos inorgánicos, una acidosis metabólica y la fatiga muscular37,84.
Por otra parte, los resultados existentes sobre el uso de antioxidantes para lograr retrasar la fatiga muscular en humanos son contradictorios, y constituyen el principal foco de discusión acerca del papel de las ROS en la fatiga muscular. En este sentido la mayoría de los suplementos con dosis y megadosis de vitaminas antioxidantes como las A y C, no han logrado demostrar una mejora en el rendimiento deportivo en ejercicios de larga duración106-108. Sin embargo, otros compuestos antioxidantes como la N-acetilcisteína (NAC), un dador de grupos tioles reducidos, ha mostrado ser efectiva en el retraso de la fatiga muscular durante ejercicios submáximos en humanos109-112. Futuros estudios son necesarios sobre el papel de los antioxidantes farmacológicos en la inactivación de ROS y su efecto sobre la fatiga muscular. Sobre todo, cuando compuestos como el NAC parecen no tener la misma efectividad para retrasar la fatiga en ejercicios de intensidad máxima que en submáximos112,113.
Daño oxidativo de los lípidos: peroxidación lipídica y lipoproteínas de baja densidad oxidadasLa peroxidación lipídica es un proceso degenerativo que ocurre en condiciones de estrés oxidativo, dañando las membranas celulares, lipoproteínas y otras estructuras que contienen fosfolípidos insaturados, glucolípidos y colesterol114. El resultado es un incremento en la formación de un gran número de productos primarios (dienos conjugados e hidroperóxidos) y secundarios (malonildialdehído [MDA], F2-isoprostanos, pentanos expirados, etanos o exanos). Si bien todos ellos han sido utilizados como marcadores de la tasa de peroxidación, la determinación de productos secundarios como única medición de la oxidación lipídica posee potenciales desventajas108,115. La medición de dienos conjugados, hidroperóxidos y MDA son probablemente los métodos más usados en el estudio de la peroxidación lipídica, pero cada uno de ellos posee distinta especificidad y reflejan fenómenos moleculares ocurridos en diferentes fases del proceso de peroxidación37,115.
El ejercicio físico puede inducir una producción exacerbada de O2 •- conduciendo también a un incremento subsiguiente de H2O2; ambas ROS pueden por sí mismas iniciar el proceso de peroxidación lipídica116, aunque son especialmente lesivas cuando interaccionan con otras ROS. Un ejemplo de esta última situación es la rápida reacción entre el O2 •- con el óxido nítrico (•NO), dando peroxinitrito (ONOO-), pero en mayor medida, generando ácido peroxinitroso (ONOOH), un potente agente oxidante y nitrante117,118. Por esta razón, la mayoría de los estudios sobre estrés oxidativo inducido por el ejercicio incluyen uno o varios marcadores de peroxidación lipídica92, aunque muy pocos han comparado el comportamiento de estos marcadores entre diferentes modalidades de ejercicio, es decir, en esfuerzos aeróbicos o anaeróbicos. Bloomer et al119 investigaron en individuos físicamente entrenados el efecto independiente de un ejercicio aeróbico (30 minutos de pedaleo al 70% VO2máx) y otro anaeróbico (30 minutos con ejercicios de media sentadilla, divididos en sesiones intermitentes de 5-12 repeticiones al 70% de una repetición máxima) sobre diferentes marcadores de estrés oxidativo en sangre. Estos investigadores no observaron ningún aumento significativo en los niveles de MDA después de ambos ejercicios, aunque el anaeróbico mostró una tendencia incremental en la concentración de este parámetro. Resultados similares fueron publicados en otros estudios que investigaron el efecto de sesiones agudas de ejercicios aeróbicos6,120 y anaeróbicos121-123 de baja o moderada intensidad (< 75% VO2máx). Sin embargo, para el ejercicio aeróbico continuo, el incremento de la intensidad del esfuerzo parece ser la variable determinante de la ocurrencia de peroxidación lipídica124, lo cual explicaría el aumento en los niveles de sustancias reactivas al ácido tiobarbitúrico y MDA observado en estudios probando ejercicios con intensidades entre el 75 y el 80% del VO2máx 125,126. Mientras que en los ejercicios anaeróbicos la peroxidación lipídica podría depender de los fenómenos de isquemia-reperfusión ocasionados por los intervalos de esfuerzo de corta duración y alta intensidad (como ocurre en los ejercicios de fuerza con varias repeticiones, separadas por cortos intervalos de recuperación). En este sentido, diferentes estudios han mostrado una incrementada peroxidación lipídica después de ejercicios isométricos capaces de generar frecuentes periodos de isquemia-reperfusión127,128, al contrario de lo observado en ejercicios isotónicos y excéntricos que reducen la ocurrencia de estos fenómenos isquémicos123,129,130. En cualquier caso, parece haber suficiente evidencia para sostener que los ejercicios anaeróbicos podrían en ciertas circunstancias provocar un mayor daño oxidativo de los lípidos que los ejercicios aeróbicos128,131.
La interpretación biológica actual sobre el incremento en los niveles de lipoperóxidos a causa del ejercicio es todavía limitada. Mientras se ha demostrado que en individuos sedentarios la lipoperoxidación desempeña un importante papel en la fisiopatología de enfermedades con estados crónicos de inflamación132, como el síndrome metabólico, la diabetes133,134, la disfunción endotelial y la arteriosclerosis135, en personas físicamente activas y deportistas el efecto negativo de la modificación oxidativa de los lípidos podría ser parcial o totalmente compensada por la reducción independiente del riesgo cardiovascular provocada por el ejercicio físico. Más aún, se ha propuesto que los hidroperóxidos lipídicos generados durante el ejercicio actúan también como señales de transducción de vías metabólicas específicas que conducen a una mayor citoprotección, como la regulación positiva de la defensa antioxidante enzimática136. La evidencia actual muestra que cantidades moderadas de ROS, como la provocada por el ejercicio, desempeñan un papel importante en los procesos de crecimiento celular, modificación postraslacional de proteínas y en la expresión de genes a diferentes niveles, incluido el endotelio137.
Por otra parte, la oxidación de las lipoproteínas de baja densidad (LDL) circulantes es un indicador del daño oxidativo que tiene lugar en la fracción lipídica del plasma, tanto en reposo como en condiciones de ejercicio, cuando la capacidad antioxidante total del plasma es superada por el estrés oxidativo. Específicamente el ejercicio físico induce oxidación de las LDL en humanos, cuando los individuos son sometidos a programas profesionales de entrenamiento con ejercicios de muy larga duración, también llamados de ultrarresistencia138. En este sentido, a pesar de las diferencias en la metodología de estudio (medición in vitro de la susceptibilidad a la oxidación, concentración de LDL oxidadas (ox- LDL) (o anticuerpos anti ox-LDL), diferentes estudios han demostrado que un alto volumen de entrenamiento se acompaña de cambios oxidativos en las partículas LDL en jugadores profesionales de fútbol y baloncesto139, en corredores de maratón140 e incluso en individuos entrenados sometidos a una sesión aguda con ejercicios de muy larga duración hasta la fatiga141-143.
Al igual que para los marcadores de peroxidación lipídica, existe en individuos sedentarios suficiente evidencia que muestra que la oxidación de las LDL incrementa la citotoxicidad y el potencial aterogénico de estas partículas, siendo clave en el proceso de quimiotaxis, inflamación y formación de la placa de ateroma144-146, y por consiguiente en la progresión de la arteriosclerosis y en la aparición de enfermedades cardiovasculares. Sin embargo, no hay evidencias que muestren que este fenómeno oxidativo se acompañe a corto plazo de manifestaciones clínicas en los atletas profesionales. Hasta la fecha, tampoco está claro que la oxidación de las LDL pueda disminuir si persiste el estímulo oxidante, o que se produzca un incremento de la capacidad antioxidante del plasma, como se ha observado frente a periodos prolongados de entrenamiento de moderada intensidad147,148. Esta última posibilidad fue sugerida por Liu et al140, quienes mostraron en maratonianos que un aumento en la concentración de ox-LDL se acompañó de un ligero incremento en la capacidad antioxidante total del plasma, fenómeno que pone de manifiesto la posibilidad de la existencia de un mecanismo de adaptación del sistema antioxidante. Sin embargo, son necesarios más estudios a la luz de los resultados para verificar este fenómeno y aclarar los mecanismos involucrados.
Es interesante considerar que la oxidación de las LDL también depende de la composición lipídica del plasma. En individuos sanos y en pacientes con diabetes tipo 2 se ha demostrado que la hipertrigliceridemia se correlaciona positivamente con la ox-LDL149,150. Frente a un incremento en la concentración plasmática de las lipoproteínas de muy baja densidad (VLDL) se produce una modificación en el tamaño, composición y densidad de las partículas de LDL151,152. Esta modificación estructural afecta la funcionalidad y el equilibrio oxidativo de la partícula, y ocurre a través de diferentes mecanismos:
1) Incremento de transferencia de triglicéridos desde VLDL a LDL.
2) Reducción del tamaño de las partículas enriquecidas en triglicéridos por acción de las lipasas.
3) Depleción lipídica y de antioxidantes, junto con un incremento de la densidad de las partículas pequeñas. Las partículas pequeñas y densas de LDL sufren, en consecuencia, un incremento en su susceptibilidad a la oxidación in vivo 153-155. Aunque esta situación no ha sido estudiada específicamente en condiciones de ejercicio, resultaría plausible que una alteración de la regulación lipídica, como la hipertrigliceridemia, pudiera interactuar con el ejercicio e incrementar así la generación de las ROS, y por consiguiente la oxidación de las LDL circulantes. Hallazgos recientes de nuestro grupo apoyan la idea de la existencia de esta interacción (alteración lipídica/estrés oxidativo) en condiciones de ejercicio e ingesta previa de fructosa156. En este estudio, un significativo incremento en la concentración de ox-LDL durante un ejercicio aeróbico de moderada intensidad se acompañó de un aumento de la trigliceridemia, junto a una reducción del tamaño de las partículas de LDL, medida indirectamente a través de la ratio LDL/ApoB (datos no publicados).
ROS y sistemas antioxidantes intracelularesEntre los antioxidantes no enzimáticos el GSH es el principal compuesto antioxidante intracelular. El GSH pertenece al grupo de los tioles, un tipo de moléculas caracterizadas por la presencia de residuos sulfidrilos en su sitio activo45. Este compuesto tiene un papel central, actuando indirectamente como sustrato para la GPx o directamente eliminando las ROS y reciclando los compuestos oxidados resultantes de la interacción oxidante/vitaminas E y C157. Asimismo, las ROS oxidan el GSH a GSSG, por lo que el estrés oxidativo puede resultar en una reducción de las reservas celulares de GSH y/o un aumento de las concentraciones de GSSG. Por ello, el GSH y el ratio GSH/GSSG son indicadores de gran interés en la determinación de la respuesta frente al estrés oxidativo, con especial especificidad para el estrés oxidativo inducido por el ejercicio158. En este sentido, una reducción de la ratio GSH/GSSG ha sido observada en diferentes condiciones de estrés oxidativo inducido por el ejercicio agudo45,159,160.
El contenido de GSH y la actividad de las enzimas antioxidantes dependientes del GSH pueden ser medidos en sangre, en plasma o en tejidos específicos como el músculo, el corazón, el hígado, el cerebro, etc. En la sangre más del 90% del GSH se encuentra en los eritrocitos, y menos del 1%, en el plasma161. Una reducción rápida, pero temporalmente breve del glutatión sanguíneo, es el fenómeno clásicamente descrito sobre la homeostasis del glutatión, tanto durante ejercicios muy intensos160,162-165 como en esfuerzos submáximos de tipo aeróbico166,167. Esta depleción del GSH se acompaña de forma paralela de un incremento igualmente agudo en los niveles de GSSG, que puede ser de hasta un 100% de los niveles basales en los primeros 15 minutos de ejercicio166. Sin embargo, no existen evidencias de un efecto acumulativo o persistente de este fenómeno sobre el estado redox del glutatión, cuando se realizan sesiones repetidas de ejercicio en un periodo de tiempo168. Más aún, la mayoría de los estudios mencionados han mostrado una normalización de los niveles de GSH en los primeros 15 minutos del periodo de recuperación al ejercicio. Debido a la participación rápida del GSH en la defensa antioxidante, la intensidad del estrés oxidativo inducido por el ejercicio en individuos sanos está directamente influenciada por la homeostasis previa del glutatión (es decir, por la relación GSH/GSSG observada antes de realizar el esfuerzo)169. Por esta razón el control del estado oxidativo previo a una intervención con ejercicio físico es de crucial importancia, a fin de reducir la variabilidad del estrés oxidativo inducido por el esfuerzo.
Entre los antioxidantes enzimáticos, un grupo de enzimas intracelulares que tiene una importancia fundamental está constituido por: SOD, CAT y GPx. Uno o varios de estos complejos enzimáticos se incrementan agudamente a causa del estrés oxidativo inducido por el ejercicio9,37,138. Sin embargo, determinar la actividad de estas enzimas permite, más que un análisis individual, realizar una interpretación cualitativa acerca de la intensidad del estrés oxidativo observado. Dékány et al observaron en diferentes estudios que algunos ejercicios de elevada intensidad, como el ciclismo en montaña y el balonmano, incrementan sustancialmente las concentraciones de SOD, y que este aumento puede correlacionarse positivamente con la actividad de la CAT, pero no con la GPx o viceversa170,171. Según este comportamiento enzimático es posible interpretar que algunos ejercicios pueden inducir un estrés oxidativo, cuya intensidad incrementa la actividad de la SOD y a continuación posiblemente satura el complejo GPx (con afinidad a bajas concentraciones de H2O2), aumentando la actividad de un complejo menos saturable, como el de la CAT. Contrariamente, ante un estrés oxidativo leve es posible que el incremento de H2O2, derivado de la activación de la SOD, sea suficientemente contrarrestado por el aumento de la actividad de la GPX, sin recurrir a la CAT.
ROS y ejercicio físico crónico: regulación positiva de las defensas antioxidantesEl ejercicio físico, especialmente el de resistencia o larga duración, incrementa las demandas de energía a nivel muscular, aumentando la capacidad oxidativa del miocito. A nivel molecular esto se refleja en un aumento de la densidad mitocondrial, un incremento de la cantidad de ATP producido172,173 y, por consiguiente también en una mayor producción de ROS. Además, entre las fuentes extracelulares de ROS, la producción de O2 •- mediada por efecto de la XO ejercería un papel igualmente importante, por su activación durante el ejercicio tanto aeróbico como anaeróbico174. Sin embargo, la posibilidad de una regulación positiva del sistema antioxidante frente al ejercicio físico crónico como fuente de ROS es una de las principales cuestiones a clarificar sobre la relevancia del estrés oxidativo inducido por el ejercicio. En humanos, el estudio del nivel de entrenamiento de los sujetos (según su VO2máx) y su relación con el comportamiento de los sistemas antioxidantes ha mostrado resultados contradictorios. Mientras que inicialmente se propuso la existencia de una relación lineal entre los niveles musculares de SOD y el estado entrenamiento175, otros autores no hallaron ninguna vinculación entre las enzimas SOD, GPx y glutatión reductasa con la actividad metabólica del músculo esquelético176. Estas discrepancias podrían ser debidas a diferencias metodológicas en relación con el muestreo y análisis de tejido muscular, procedente de músculos humanos con diferente característica metabólica. En modelos animales se ha demostrado que los músculos con predominio de fibras oxidativas, como es el caso del sóleo, tienen un contenido de GSH, GPx y glutatión reductasa significativamente mayor que otros músculos menos oxidativos45,177. En consecuencia, es posible que la modulación específica de uno o varios de los sistemas de defensa antioxidante a causa del entrenamiento crónico también sea altamente dependiente de la línea muscular analizada. Este fenómeno explicaría el hecho de que un cambio en la capacidad oxidativa del músculo no predice linealmente la adaptación crónica del sistema antioxidante178.
Desafortunadamente, pocos estudios longitudinales han evaluado en humanos las adaptaciones específicas de los sistemas antioxidantes después de un periodo sistemático de entrenamiento con ejercicio físico de tipo aeróbico. Tonkonigi et al105 observaron que un programa de 6 semanas de entrenamiento aeróbico moderado, que resultó en un incremento del 40% en la capacidad oxidativa máxima del músculo (medida directamente a través del consumo de O2 en aislado mitocondrial), no generó ningún incremento de la capacidad enzimática antioxidante ni del estado del glutatión del músculo. Estos autores especularon que la persistencia de la situación mencionada podría conducir al desequilibrio oxidativo, siendo el paso previo a la regulación positiva de las defensas antioxidantes. En otro estudio, un mayor periodo de entrenamiento (8 semanas) con ejercicio físico de tipo aeróbico, también indujo adaptaciones fisiológicas del metabolismo energético (incremento del VO2máx y la efectividad del ciclo de Krebs) que no se acompañaron de modificaciones en la actividad enzimática antioxidante, ni en la homeostasis del glutatión55.
Es evidente que la duración del estímulo sistemático, desempeñado por el ejercicio como fuente de ROS, es la variable menos conocida en relación con la regulación positiva del sistema antioxidante frente al ejercicio crónico. Por el contrario, existe un consenso sobre la importancia de dos factores: la intensidad moderada y la repetición sistemática del ejercicio. En este sentido se ha sugerido que un ejercicio de tipo aeróbico con una intensidad de al menos un 50% del VO2máx es necesario para que la producción de ROS supere una capacidad antioxidante normal, induciendo así una situación de estrés oxidativo179. Por consiguiente, cada sesión de ejercicio provocaría señales basadas en una cantidad no patológica de estrés oxidativo, que conducirían por efecto acumulativo a una adaptación crónica del sistema de defensa. Este mecanismo fue propuesto a partir del fenómeno observado en ratas crónicamente entrenadas, en las que la regulación positiva del sistema antioxidante (incremento actividad mitocondrial de SOD y GPx, entre otras) fue suficiente para reducir el daño oxidativo provocado por un ejercicio físico extenuante, en comparación con ratas sedentarias sin la adaptación del sistema antioxidante180. Estudios posteriores en modelos animales sobre las adaptaciones del sistema antioxidante frente al ejercicio físico crónico han demostrado que de 6 a 10 semanas de entrenamiento de resistencia incrementan significativamente el contenido de GSH en el músculo y otros tejidos, como el hígado o el cerebro, en comparación con animales no entrenados181-183; un efecto semejante ha sido descrito por diferentes estudios tras 10 semanas de entrenamiento, en relación con la GPx y glutatión reductasa a nivel muscular184,185. Hollander et al186 propusieron además que la regulación positiva del sistema antioxidante enzimático sería activada a través de las vías de señalización ejercidas por un incremento en la trascripción del factor de nuclear κβ (NF-κβ) después del ejercicio. Esta idea fue reforzada más recientemente en humanos, donde la activación de las vías de transcripción de NF-κβ en linfocitos fue inhibida por el tratamiento con alopurinol (un inhibidor de la XO) durante una carrera de maratón187.
Ingesta dietética, ejercicio y estrés oxidativoExisten factores extrínsecos al ejercicio físico que pueden incrementar la producción de ROS en el organismo o deteriorar la efectividad del sistema de defensa antioxidante, como es el caso de las condiciones ambientales y la dieta del deportista. Estos factores pueden ser considerados como co-factores de riesgo oxidativo (fig. 6), puesto que aumentan el riesgo de daño y estrés oxidativo a causa de su efecto acumulativo sobre las propias fuentes de ROS del ejercicio físico.
Fig. 6. Fuentes primarias de ROS durante el ejercicio y cofactores de riesgo oxidativo asociados al ejercicio.
Dieta, ejercicio y ROSUn modelo dietético con una ingesta variada de frutas y vegetales, como por ejemplo la dieta mediterránea, no sólo tiene un efecto favorable sobre los lípidos sanguíneos, sino también protege contra el estrés oxidativo debido a su elevado aporte de nutrientes con funciones antioxidantes188. Contrariamente a un modelo dietético con escasa variedad y cantidad de estos alimentos, que aporta un exceso de calorías, sal y grasas saturadas, incrementa el riesgo de estrés oxidativo al favorecer la formación de ROS y al reducir el aporte de antioxidantes exógenos (vitaminas E, C, carotenoides y polifenoles) y micronutrientes como el selenio189-191. Por lo tanto, es evidente que la dieta del deportista puede actuar como un factor de protección contra el estrés oxidativo, o como un factor de riesgo para su ocurrencia. Diferentes estudios han mostrado que los deportistas tienen ingesta dietética de vitaminas antioxidantes (C y E) dentro de límites recomendados o incluso por encima de ellos192,193. Además, una ingesta normal de vegetales y frutas no sólo asegura una ingesta adecuada de vitaminas liposolubles e hidrosolubles, sino también precursores de la síntesis de GSH, como el ácido lipoico, hallado en su forma de lipoil-lisina en diferentes alimentos vegetales como espinacas, brócoli, tomates y guisantes verdes y en alimentos animales, especialmente vísceras y derivados194. Sin embargo, es posible que algunos grupos de deportistas tengan una ingesta inadecuada de nutrientes antioxidantes a causa de un consumo reducido de vegetales y frutas, como aquÉllos que realizan dietas altas en CHO, o debido también a la restricción en la ingesta de aceites y grasas ricas en vitaminas liposolubles (bailarinas, gimnastas, etc.)192,195. Otros atletas podrían tener una demanda incrementada de antioxidantes debido al entrenamiento en condiciones ambientales extremas (altitud, temperatura, etc.) o al hábito de fumar196. En cualquier caso, el rendimiento deportivo parece no estar afectado significativamente por deficiencias marginales de vitaminas antioxidantes195, mientras que los estudios con suplementación vitamínica no han demostrado que una ingesta superior a las recomendadas pueda mejorar del rendimiento deportivo197. Además, ante el riesgo de posibles efectos pro-oxidantes de una ingesta excesiva de vitaminas antioxidantes a través de suplementos en dosis farmacológicas198, la estrategia más segura para reducir el riesgo de estrés oxidativo inducido por el ejercicio es una dieta variada y rica en alimentos vegetales.
Estado postprandial, ejercicio y ROSDurante el reposo en situación postprandial la hiperglucemia y la hipertrigliceridemia pueden, de forma independiente, inducir estrés oxidativo tanto en individuos sanos como en enfermos199. La hiperglucemia provoca de forma dosis-dependiente un rápido incremento en los niveles de MDA, así como la respuesta de los sistemas enzimáticos de defensa antioxidante (SOD, CAT y GPx)200. La autooxidación de las moléculas de glucosa es uno de los mecanismos asociados a la generación de ROS durante la hiperglucemia201. Las ROS directamente derivadas de este fenómeno son: O2 •-, OH- y H2O2, que pueden provocar daño oxidativo en lípidos y proteínas, activar el sistema enzimático de la lipooxigenasa202 e inactivar importantes compuestos de la homeostasis vascular, como el NO o interferir en su producción al inhibir la actividad de la NOS203-205. Otra fuente de ROS depende de la formación secundaria de compuestos que dependen del destino metabólico no oxidativo del hidrato de carbono (HC) ingerido, como es el caso de los triglicéridos sintetizados ex novo tras la ingesta aguda o crónica de los CHO, o la propia acumulación de glucosa o productos metabólicos intermedios en diferentes compartimentos.
En relación con el ejercicio físico es posible que los fenómenos vinculados a la respuesta glucémica sean los que coinciden en mayor frecuencia con la producción de ROS dependiente del esfuerzo físico. La suplementación ergogénica con alimentos ricos en carbohidratos, o simplemente el hábito dietético de las personas físicamente activas, serían la causa de esta asociación. Al igual que fue demostrado en condiciones de reposo, el estado postprandial podría ser un importante factor de riesgo oxidativo, incrementando la producción de ROS propia del esfuerzo físico206. Además, las características aeróbicas o anaeróbicas del esfuerzo determinan diferentes necesidades de carbohidratos para la producción de energía, lo que podría modificar también el destino metabólico de los HC ingeridos. En este sentido, existe poca información acerca de este posible efecto de interacción dieta-ejercicio sobre el estado oxidativo en individuos sanos. En un reciente estudio publicado por nuestro grupo156, 20 deportistas sanos ingirieron en dos situaciones consecutivas 50 g de glucosa o 50 g + 15 g de fructosa 15 minutos antes de realizar un ejercicio aeróbico de moderada intensidad. Aunque la tolerancia glucémica no fue modificada en este estudio por la dosis extra de fructosa, un significativo incremento de la trigliceridemia y del estrés oxidativo fue observado durante y después del esfuerzo con el suplemento combinado. Este fenómeno relacionado con la respuesta lipídica y el estado oxidativo no ocurrió cuando los mismos sujetos realizaron, en una ocasión diferente, una sesión de ejercicio predominantemente glucolítico (10 series de 10 repeticiones de media sentadilla, 80% de 10 RM) con el mismo suplemento (datos no publicados) o cuando ingirieron antes de los mismos ejercicios un suplemento formado sólo por glucosa, lo cual nos conduce a pensar que la necesidad de glucosa durante el ejercicio podría modular de forma diferencial el destino metabólico del CHO ingerido, y por lo tanto su posible efecto sobre la generación de ROS.
La fructosa es un monosacárido que posee especial relevancia a causa de la relación con la existencia de estrés oxidativo, y por su frecuente inclusión en bebidas deportivas y alimentos que tienen por objeto un incremento del rendimiento deportivo207,208. En condiciones de reposo este HC provoca en las 24 horas siguientes a su ingesta menor glucemia, insulinemia y secreción de grelina que una dosis isocalórica de glucosa209; sin embargo, el incremento de su concentración en la vía portal y en el hígado a ctiva diferentes vías de estrés metabólico asociadas a la producción de ROS210. Además, debido a que la fructosa evita dos pasos reguladores de la glucólisis (la acción de la glucocinasa y fosfofructocinasa) provocaría la acumulación de productos glucolíticos intermediarios para la síntesis de triglicéridos, como el gliceraldehído-3-fosfato, que puede servir de sustrato para la generación de productos finales de glucación y ROS, así como activar las vías inflamatorias a través de NF-κβ211. Por otra parte, la fructosa es combinada frecuentemente en diferentes proporciones con glucosa (resultando sacarosa o jarabe de maíz alto en fructosa), cuya ingesta ha demostrado inducir un incremento agudo de la concentración de los triglicéridos del plasma212-214. La síntesis ex novo de triglicéridos en el hígado resultaría de la activación de reguladores transcripcionales de la síntesis de ácidos grasos como el SREBP-1c, cuya activación ha mostrado ser dos veces más rápida en ratones tras la ingesta de glucosa combinada con fructosa que después de consumir sólo glucosa215. Estos triglicéridos que son transportados fuera del hígado por las VLDL, también podrían sufrir procesos de autooxidación o modificar el estado oxidativo del plasma al interactuar con las partículas de LDL, como se describió previamente. En cualquier caso, se precisa de más estudios que amplíen el conocimiento sobre la suplementación con carbohidratos y el estado oxidativo durante el ejercicio.
ConclusionesEl ejercicio físico induce, en grado variable, un estrés metabólico y mecánico que puede provocar un desequilibrio de la homeostasis oxidantes/antioxidantes en favor de los compuestos oxidantes. No uno, sino varios mecanismos fisiológicos, participan en la producción de las ROS durante el ejercicio; pero además, existen otros factores extrínsecos al ejercicio (factores de riesgo oxidativo) que pueden favorecer la ocurrencia de estrés oxidativo, como la dieta, la situación postprandial, la temperatura, el grado de hidratación, el nivel de entrenamiento del individuo, etc. Aunque el estrés oxidativo es potencialmente relevante entre los mecanismos vinculados a la fatiga muscular, la recuperación frente al ejercicio, e incluso quizás también para un mejor rendimiento deportivo, existe un creciente número de publicaciones que lo vinculan con la ocurrencia de fenómenos adaptativos del sistema inmunológico y de la defensa antioxidante del deportista, lo que conduce en última instancia a una mayor citoprotección y resistencia biológica del organismo.