Introducción
Las enfermedades crónicas no transmisibles (ECNT), especialmente las derivadas del sistema cardiometabólico (hipertensión arterial [HTA], obesidad, diabetes mellitus tipo 2, enfermedad isquémica cardíaca, etc.), según la Organización Mundial de la Salud (OMS), se consideran un problema de salud pública que lleva a serias consecuencias sociales, psicológicas y físicas, y se asocian a un riesgo de morbimortalidad mayor por sus complicaciones1. El aumento poblacional, la urbanización, la natalidad y la disminución de las tasas de mortalidad parecen ser algunos de los principales factores involucrados en la aparición y la evolución de las ECNT. Actualmente se postula que las ECNT se deben a factores de riesgo cardiovasculares, algunos de ellos prevenibles, como la obesidad central, el sedentarismo, la resistencia a la insulina (RI), etc.2,3. Al mismo tiempo, otros estudios han mostrado que existe confluencia de varios factores endógenos y mecanismos en un mismo individuo4, entre los que sobresalen la disfunción endotelial (DE)5,6, la HTA7, la RI8, la dislipidemia9 y un elevado estrés oxidativo10.
Para resolver la problemática de las ECNT, en los últimos tiempos, la OMS10,11 ha estimulado iniciativas para la vigilancia mundial de los factores de riesgo asociados, exhortando y apoyando a los países para el diseño y la realización de estudios poblacionales, para poner en práctica intervenciones saludables y para la aplicación de programas de vigilancia y planes de acción globales y regionales12. Es así como la implementación de programas con ejercicio físico (EF) aparecen como una alternativa de tratamiento y prevención de varios de los factores de riesgo cardiovasculares. Hoy sabemos que la actividad física es un factor eficaz para reducir la mortalidad por ECNT, y, por tanto, debe formar parte de las actividades de la vida cotidiana13. Además de reducir la mortalidad, hay evidencia de que el aumento de la condición física puede mejorar la salud14 y reducir el riesgo de una serie de enfermedades crónicas, como enfermedades cardiovasculares15,16, diabetes mellitus tipo 217, osteoporosis18, obesidad19, depresión20 y cáncer de mama y de colon21.
De hecho, una disminución en la capacidad física medida por el volumen de oxígeno máximo (VO2máx) se considera como un predictor independiente por muertes cardíacas y por todas las causas de muertes por ECNT en individuos sanos y en aquellos con enfermedad cardiovascular22. En individuos sanos, como en aquellos con enfermedad cardiovascular, el VO2máx se muestra como el predictor más fuerte y de mayor riesgo de mortalidad, en comparación con los factores de riesgo clásicos como HTA, obesidad, tabaquismo y diabetes mellitus tipo 223.
Curiosamente, en el estudio de Wisloff et al24 se demostró un incremento en el riesgo cardiometabólico, después de 11 generaciones de reproducción con ratas que presentaban baja capacidad de ejercicio por VO2máx. Es decir, en condiciones experimentales, se demostró que una menor aptitud física predecía la aparición de enfermedades cardiovasculares y metabólicas.
La evidencia actual indica que en intervenciones que busquen incrementar el VO2máx podría ser tan efectivo como el tratamiento médico y farmacológico -y en situaciones especiales más eficaz- o añade a este efecto. En este contexto, el tratamiento con EF representa un cambio en el paradigma biomédico y es urgente aplicarlo en la práctica médica. El objetivo de esta revisión es presentar las pruebas científicas del uso del EF como tratamiento no farmacológico en el tratamiento y el manejo de algunos de los factores de riesgo cardiovascular.
Sobrepeso y obesidad
La obesidad se constituye en un factor de riesgo que está extremadamente ligado al proceso ateroesclerótico y a la predisposición de ECNT. Hoy se reconoce que la obesidad central (medida por la circunferencia de cintura) es un mejor predictor de enfermedades como síndrome metabólico (SM) que la obesidad general25. Pitanga y Lessa26 demostraron que una circunferencia abdominal y la razón de cintura/cadera son más apropiados que el índice de masa corporal (IMC) en la diferenciación de enfermedades metabólicas como el SM. De hecho, Lakka et al27 encontraron una relación entre la obesidad abdominal con el desarrollo de ateroesclerosis, independiente del IMC y de otros factores de riesgo.
Asimismo, un incremento del tejido adiposo a nivel abdominal se ha relacionado directamente con un estado de RI e hiperinsulinismo28,29. La hiperinsulinemia promueve la liberación de ácidos grasos libres por parte del adipocito y su posterior transformación hepática a lipoproteína de baja densidad (LDL) oxidada, de gran potencial aterogénico30. Además, los adipocitos abdominales en respuesta al incremento de ácidos grasos libres, de LDL oxidada o de algún otro factor metabólico no bien definido, aumentan la producción y la liberación de citocinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α, en sus siglas en inglés) e interleucina (IL) 6, las cuales han mostrado ser capaces de disminuir la expresión y la actividad del óxido nítrico sintasa endotelial (eNOS), enzima encargada de la producción del óxido nítrico (NO, en sus siglas en inglés)31.
Efectos del ejercicio en el sobrepeso y la obesidad
El metaanálisis realizado por Shaw et al32 en 2005 incluyó 43 estudios con 3.476 participantes. Aunque la heterogeneidad significativa en algunos de los análisis de los efectos principales limitó la capacidad de agrupar el tamaño de los efectos en algunos estudios, se calculó un número de tamaños de efectos agrupados. En comparación con ningún tratamiento, el EF produjo pérdidas de peso pequeñas en los estudios. Sin embargo, la combinación del EF con una dieta produjo una mayor disminución media de peso (DMP) que la dieta sola (DMP -1,1 kg; intervalo de confianza [IC] del 95%, -1,5 a -0,6). El incremento de la intensidad del EF aumentó la pérdida de peso (DMP -1,5 kg; IC del 95%, -2,3 a -0,7). Hubo diferencias significativas de otras medidas de resultado, como los lípidos séricos, la presión arterial y la glucosa en plasma en ayunas. El EF como única intervención para la pérdida de peso produjo reducciones significativas de la presión arterial diastólica (DMP -2 mmHg; IC del 95%, -4 a -1), de los triglicéridos (DMP -0,2 mmol/l; IC del 95%, -0,3 a -0,1) y de la glucemia en ayunas (DMP -0,2 mmol/l; IC del 95%, -0,3 a -0,1). Sumado a lo anterior, el EF de intensidad más alta produjo una reducción mayor de la glucemia en ayunas que el EF de intensidad más baja (DMP -0,3 mmol/l; IC del 95%, -0,5 a -0,2), aunque no se identificaron datos acerca de episodios adversos, calidad de vida, morbilidad, costes o mortalidad. Los resultados de esta revisión favorecen el uso del EF como una intervención para la pérdida de peso, particularmente en combinación con un cambio de dieta. Esta mejoría en los marcadores de riesgo cardiovascular se debe al efecto metabólico inducido por el EF, especialmente en las fracciones lipídicas y glucémicas, sin cambios en el peso corporal.
Contrariamente, Kretschmer et al33 demostraron que un programa de 5 semanas de EF aeróbico era eficiente en el mantenimiento y la reducción del peso corporal (expresado en porcentaje de grasa) con incremento en la sensibilidad a la insulina. Savage et al34 mostraron que un programa de 4 meses de EF, consistente en caminatas de 60-90 minutos 5-7 veces por semana, a una intensidad del 50-60% del VO2máx, era eficiente en la reducción de peso corporal (4-6 kg) en pacientes coronarios con sobrepeso, y que además del cambio en el peso corporal hubo reducción del porcentaje de grasa (2 y 9%), tejido adiposo subcutáneo y visceral (el 12 y el 14%, respectivamente) y cambios en el perfil lipídico (principalmente, una reducción de 23% en los triglicéridos [TG]).
Prescripción del ejercicio en el sobrepeso y obesidad
Cabe destacar que la pérdida de peso requiere un equilibrio negativo de calorías y que ella no puede lograrse si el gasto de energía durante el EF tiene una compensación por la ingesta de alimentos. Muchos pacientes con sobrepeso y obesidad de forma concomitante pueden presentar HTA o síntomas isquémicos de enfermedad cardiovascular. La recomendación, en tanto, debe ser individualizada, aunque se pueden seguir las recomendaciones generales para la población sana, considerando que la cantidad de EF debe ir aumentado progresivamente. Entonces, el objetivo es realizar por lo menos 30 minutos de EF a intensidad moderada (determinado con la escala de Borg 12-13, combinado con cortos períodos intensos en la escala de Borg 15-16) al día. Si el objetivo principal es afectar el peso corporal significativamente, es necesario realizar un mínimo de 1 hora de EF diario o su equivalente a 400-600 kcal/día. Se indica hacer actividades cíclicas que impliquen la participación de la mayor cantidad de masa muscular, como caminar o trotar en cinta sin fin o a cielo abierto, practicar ciclismo en bicicleta ergométrica o natación, según sea el caso.
Contraindicaciones
No hay contraindicaciones absolutas en este caso, aunque para la prescripción del EF debe considerarse la existencia de comorbilidades. Por ejemplo, en pacientes con enfermedad arterial coronaria, se debe abstener de practicar EF intenso (puntuación en la escala de Borg 15-16). En pacientes obesos y con HTA, la realización del entrenamiento muscular local con pesos ligeros deberá considerar cargas submáximas (entre el 40 y 70% de la repetición máxima [RM] calculada previamente).
Hipertensión arterial
La HTA parece ser otro de los principales factores asociados al SM y a varias enfermedades cardiovasculares. En arterias aisladas de modelos experimentales de HTA, se observa una reducción de la vasodilatación mediada por flujo (VMF) -característica fisiopatológica de la activación del endotelio vascular-. Sin embargo, en muchos pacientes con HTA no se observa un deterioro de la VMF, y en la mayoría de las formas de HTA este mecanismo no parece ser la causa de la elevación de la presión arterial. De hecho, la activación del endotelio vascular se observa en individuos normotensos provenientes de familias con alta incidencia de HTA esencial, por lo que podría ser un factor predisponente de HTA35.
Efectos del ejercicio en la presión arterial sistémica
Se han realizado muchos estudios que relacionan la disminución de presión arterial con la práctica regular de EF36-38. Las respuestas más estables en la presión arterial durante el EF pueden observarse después de 1-10 semanas de entrenamiento aeróbico, como lo verificaron Hagberg et al36. El Colegio Americano de Medicina del Deporte (ACSM)37 estableció patrones para la intensidad del EF con el objetivo de reducir la presión arterial, y se estableció que el paciente hipertenso debe practicar EF moderado entre el 40 y el 60% del VO2máx. Esta reducción se explica mediante diversos factores, entre ellos: la reducción de la actividad nerviosa simpática, del sistema renina-angiotensina, una mejor respuesta vascular, un aumento de la capilarización y un aumento del lumen arterial. Moreira et al38 verificaron que el EF aeróbico a 2 intensidades diferentes (el 25 y el 60% del VO2máx) durante 10 semanas, propiciaron resultados semejantes en la reducción de presión arterial ambulatoria. Lerman et al39 encontraron una relación positiva entre el nivel de actividad física y la reducción de la HTA.
Prescripción del ejercicio en pacientes hipertensos
Muchos pacientes con HTA pueden seguir las recomendaciones generales para la práctica de EF en población sana. El objetivo es cumplir por lo menos 30 minutos de EF a intensidad moderada (escala de Borg 12-13, combinado con períodos cortos e intensos según la escala de Borg 15-16) al día. Se indica hacer actividades cíclicas, como caminar o trotar en cinta sin fin o a cielo abierto, o ciclismo en bicicleta ergométrica. En pacientes con HTA y otras comorbilidades, la realización del entrenamiento muscular local con pesos ligeros deberá considerar cargas submáximas (entre el 40 y el 70% de la RM calculada previamente). También se puede sustituir el entrenamiento de fuerza con circuitos de resistencia muscular dos veces por semana.
Contraindicaciones
De acuerdo con las directrices del ACSM40, las personas con presión arterial mayor de 180/105 mmHg deberán iniciar farmacoterapia antes de participar de un programa de actividad física regular (contraindicación relativa). No hay evidencia de riesgo mayor de muerte súbita o de un accidente cerebrovascular en personas físicamente activas con HTA41.
Para este fin, el ACSM recomienda precaución cuando se realiza EF muy intenso, dinámico o acondicionamiento físico de fuerza-resistencia con pesos elevados (cargas > 75% de la RM), debido al incremento en la presión del ventrículo izquierdo (> 4.300 mmHg), aspecto que puede ser potencialmente peligroso. Los pacientes con enfermedad coronaria deberán abstenerse de sesiones de EF intenso (escala de Borg > 15-16).
Dislipidemia
Múltiples factores de riesgo actúan de manera sinérgica en el desarrollo de la enfermedad cardiovascular y del SM, pero se considera que los lípidos alterados y el espesor arterial medio, como indicadores de la integridad arterial, quedan afectados de forma temprana42. La dislipidemia se caracteriza principalmente por los niveles elevados de colesterol unido a LDL (cLDL), colesterol unido a lipoproteínas de muy baja densidad (cVLDL) y TG, y niveles bajos de colesterol unido a lipoproteínas de alta densidad (cHDL)43. Aunque los efectos del cLDL y cHDL sobre el riesgo de SM están ampliamente documentados, el efecto causal de las variaciones del cHDL se encuentra aún en debate, dado que algunos desórdenes del metabolismo de lípidos caracterizados por niveles muy bajos de esta fracción lipídica (por ejemplo en deficiencias genéticas de ABCA-1, LCAT y la mutación Milano del gen APOA-1) no parecen presentar un elevado riesgo de SM44. Por otro lado, valores elevados de TG, tanto basales como posprandiales, parecen estar asociados de forma independiente con el riesgo de enfermedad cardiovascular, aunque con un efecto de menor magnitud con el cLDL45. En este sentido, algunos autores han indicado que los valores de TG posprandiales podrían tener un efecto de mayor relevancia que los TG en ayunas como predictores del riesgo cardiovascular46,47.
Efectos del ejercicio en la dislipidemia
El EF es una herramienta eficaz para modificar el perfil lipídico, actuando de forma significativa en los índices de cHDL y la reducción de cLDL y los TG séricos48-52. Rique et al48 explican que la modificación en los hábitos de vida, entre ellos la nutrición y la práctica de EF regular, pueden llevar a una disminución en las fracciones lipídicas asociadas a la aparición del SM y a la enfermedad cardiovascular. En un metaanálisis realizado por Kelley et al49, se demostró que el EF (> a 8 semanas) era capaz de aumentar significativamente los valores de cHDL en adultos mayores de 18 años. Roberts et al50 encontraron que el EF por espacio de 3 semanas, además de mejorar el perfil metabólico, disminuyó la presión arterial y la capacidad antioxidante total. Lalonde et al51 observaron que las intervenciones más rigurosas (dieta con ejercicio) propiciaron mejores resultados con relación a los efectos en el perfil lipídico y calidad de vida que las intervenciones menos rigurosas (dieta sin ejercicio). La dieta asociada con el EF propició una reducción mayor del cLDL y aumentó el cHDL. Couillard et al52 verificaron que 20 semanas de entrenamiento aeróbico de resistencia fue más efectivo en el aumento del cHDL en personas con niveles altos de TG y niveles bajos de cHDL, que en personas con hipertrigliceridemia y niveles bajos de cHDL.
Al analizar a individuos asiáticos, Bhalodkar et al53 verificaron que el grupo que se ejercitaba habitualmente presentaba mejores concentraciones de cHDL. Además, el tamaño de las partículas de cHDL eran especialmente mayor en el grupo con EF comparado con el grupo inactivo. Matos y Ladeia54 confirmaron que los niveles considerados como normales de TG séricos y colesterol total estaban presentes en individuos con una relación menor de cintura cadera y mayor gasto calórico.
Prescripción del ejercicio en dislipidemia
Muchos pacientes con dislipidemia presentan comorbilidades, como HTA o enfermedad cardiovascular isquémica sintomática. La recomendación debe individualizarse, aunque se pueden seguir las recomendaciones generales para la población sana, considerando que la cantidad de EF debe ir aumentado progresivamente55. La intensidad del EF puede ser de moderada a alta. El paciente deberá cumplir sesiones de caminata o trote por lo menos 20-30 km/semana. La realización de sesiones intermitentes (2) diarias, pueden tener un efecto beneficioso en los lípidos sanguíneos.
Contraindicaciones
No hay contraindicaciones absolutas en estos pacientes, aunque la prescripción del ejercicio deberá considerar las comorbilidades. Los pacientes con enfermedad coronaria deberán abstenerse de practicar EF intenso (escala de Borg 15-16). Los pacientes con HTA deberán realizar entrenamiento de la fuerza con cargas ligeras (RM del 40 y el 70%)56.
Función endotelial
El endotelio vascular tiene características antiinflamatorias, anticoagulantes, antiproliferativas y antitrombóticas en estado fisiológico (fig. 1). La función endotelial es afectada por factores de riesgo cardiovasculares, como sedentarismo, RI, estrés oxidativo, dislipidemia, tabaquismo e HTA57, así como agudamente por privación del sueño, estrés mental, modificaciones hormonales, EF, ciclo menstrual y patrón dietario58.
Fig. 1. Sustancias vasoactivas derivadas del endotelio. Tanto el estrés del flujo vascular, como diversos factores bioquímicos sanguíneos: acetilcolina (Act) y bradiquininas (Br) pueden activar receptores específicos de la membrana celular endotelial, con la liberación de moléculas relajantes, como óxido nítrico (NO) y factor hiperpolarizante derivado del endotelio (EDHF, en sus siglas en inglés). Estas moléculas estimulan en el músculo liso vascular la producción de segundos mensajeros intracelulares, como guanosín monofosfato cíclico (GMPc) y adenosín monofosfato cíclico (AMPc), con el consiguiente aumento de la permeabilidad celular al facilitar la relajación y disminuir la agregación plaquetaria. Ca: calcio; K: potasio; L-Arg: L-arginina; v: voltaje.
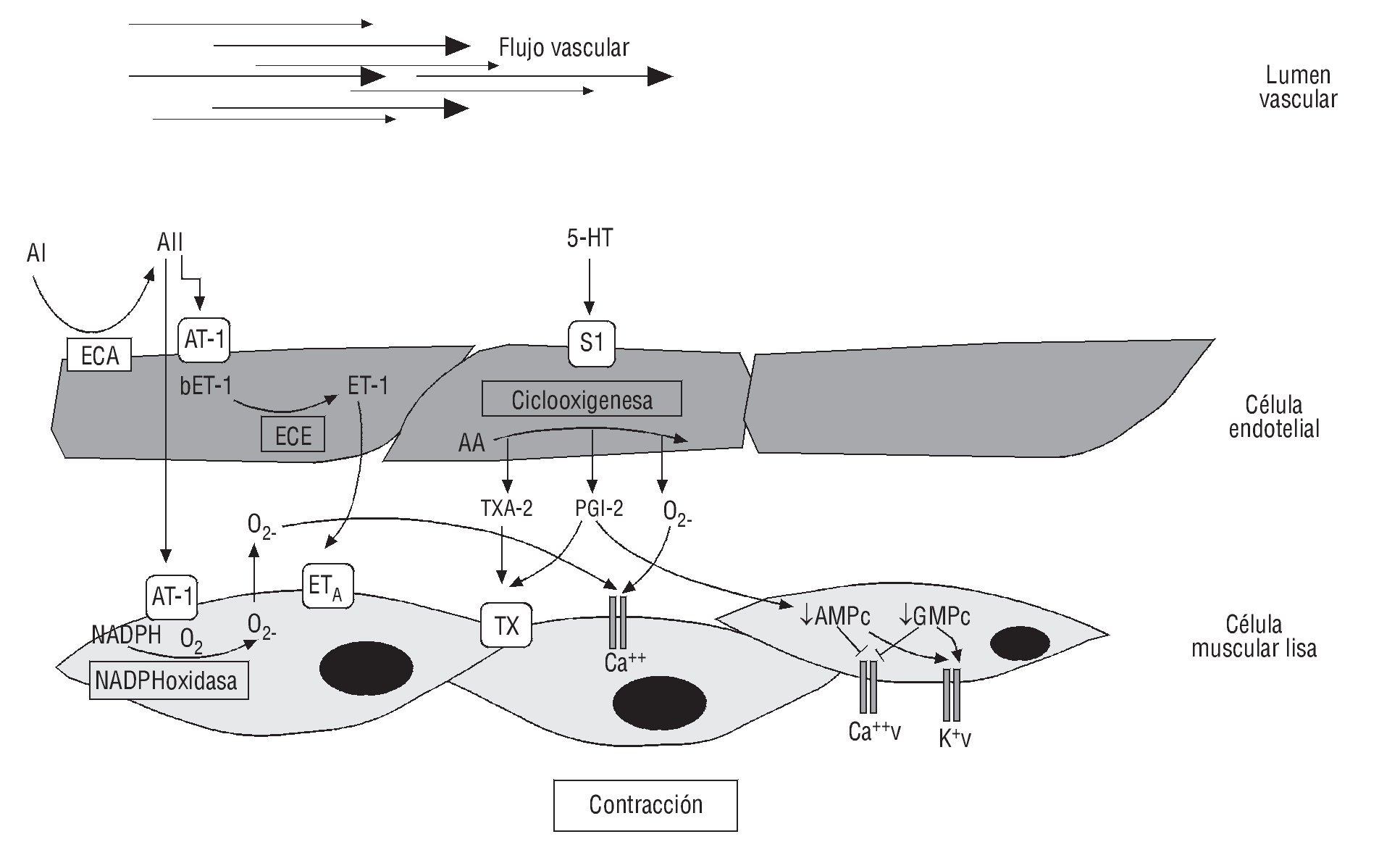
Cambios en el fenotipo vascular generan DE, como efecto del desequilibrio entre las sustancias que producen vasoconstricción y vasodilatación. La DE se considera un marcador temprano de aterosclerosis, antes de las primeras evidencias angiográficas de la placa aterosclerótica59, y puede estar presente desde la infancia60. En pacientes o individuos con un elevado número de factores de riesgo, se produce un estado de estrés oxidativo (EO) y se ha demostrado que este estado metabólico puede inactivar la producción y la biodisponibilidad del NO. Adicionalmente, el fenómeno inflamatorio que tiene lugar durante la fase temprana del SM favorece el incremento en los niveles séricos de distintas moléculas y citocinas, como la angiotensina I y II y el TNF-α, promoviendo la sobreexpresión de receptores AT-1 y AT-2 y el aumento de la actividad de la NADPH oxidasa, con el consecuente efecto de un EO, mecanismo relacionado con el fenotipo endotelial contráctil61 (fig. 2).
Fig. 2. Mecanismo de disfunción endotelial. Sustancias como: endotelinas (ET-1), angiotensina I y II (AI, AII), tromboxanos (TXA-2), prostaglandinas (PGI-2), y citocinas inflamatorias, como factor de necrosis tumora alfa (TNF-α), pueden producir un fenotipo contráctil. AA: ácido araquinoico; AT1: receptor de angiotensina 1; AMPc: adenosín monofosfato cíclico; Ca: calcio; ECA: enzima de conversión de la angiotensina; ECE: enzima de conversión de la endotelina; GMPc: guanosín monofosfato cíclico; K: potasio; NADPH: nicotinamida adenina dinucleótico fosfato; S1: receptor de serotonina; v: voltaje.
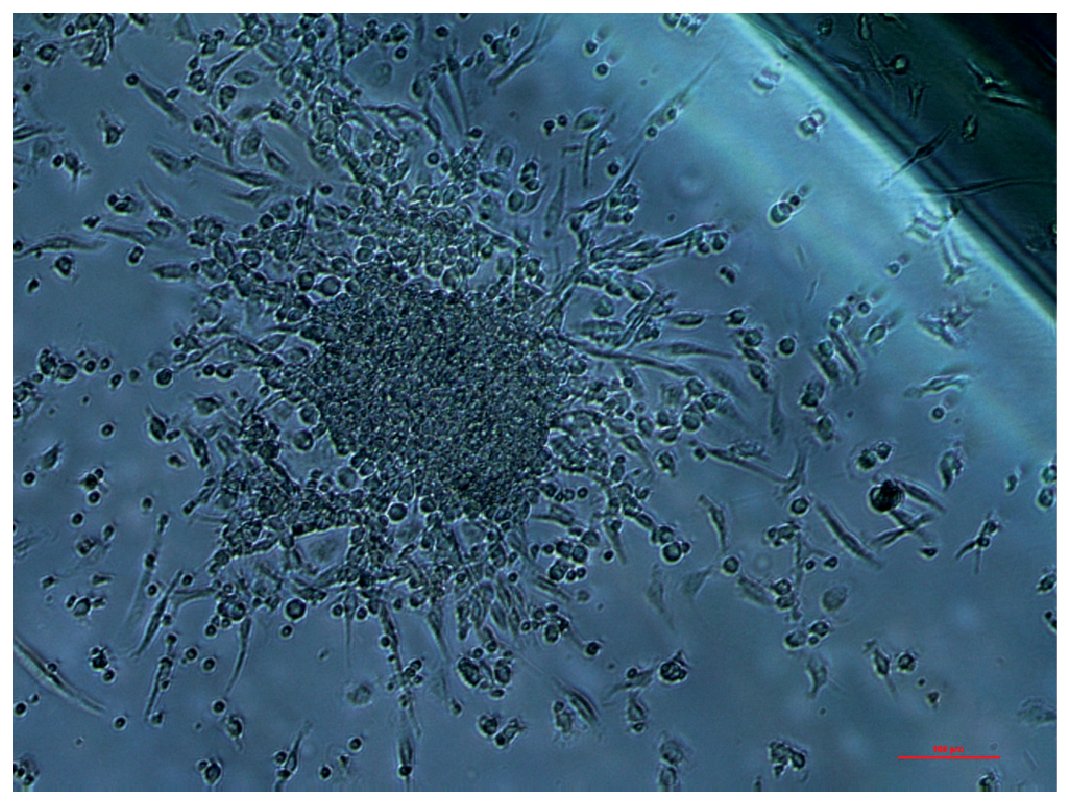
Otra evidencia emergente indica que el equilibrio entre los fenómenos de muerte celular endotelial y renovación celular endotelial -y que en parte se explica por la biodisponibilidad y función de un subconjunto de células madre derivadas de la medula ósea, llamadas células endoteliales progenitoras- favorece la conservación de una normal función endotelial. Estas células pueden ser movilizadas hacia la zona de muerte celular o lesión endotelial, activando diferentes mecanismos de reparación o regeneración del endotelio (neovascularización, formación de colonias de regeneración etc.); lo cual no ocurriría eficazmente en un endotelio disfuncional62 (fig. 3). De acuerdo con ello, Hill et al63 mostraron que el grado de DE se correlacionaba inversamente con el número de células endoteliales progenitoras, indicando un posible mecanismo de DE causado por una deficiencia relativa de células endoteliales progenitoras.
Fig. 3. Colonia típica de células progenitoras endoteliales, que en individuos sanos pueden obtenerse en un número de hasta 30 UFC/ml de sangre, usando un medio EndoCult®; mientras que en pacientes con síndrome metabólico, la obtención en idénticas condiciones se reduce hasta 1-3 UFC/ml. Fotografía cedida por el Grupo BO2, Lípidos y Arteriosclerosis, IMIBIC/UCO/HURS.
Efectos del ejercicio en la disfunción endotelial
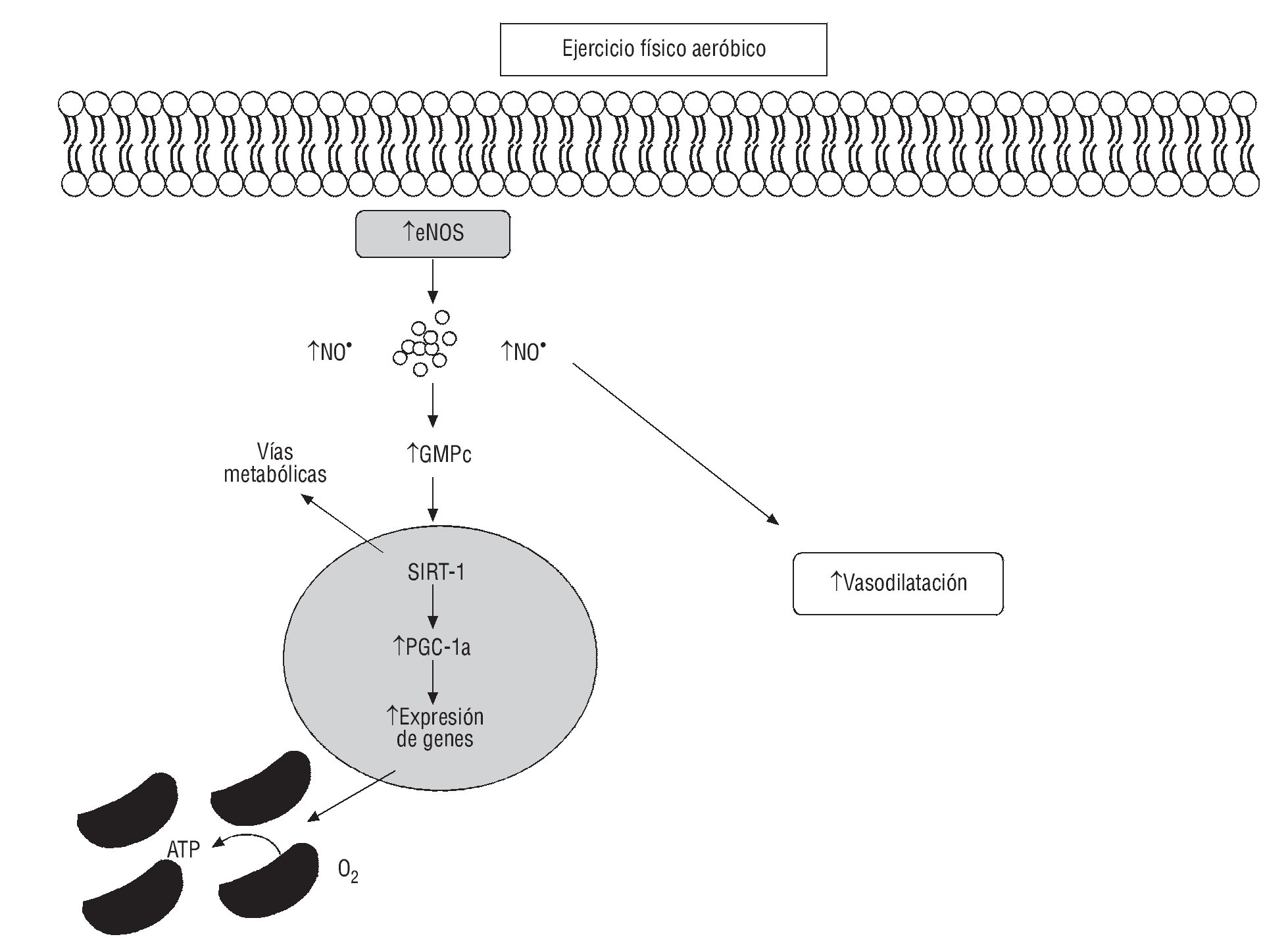
Varios estudios han demostrado que diversas intervenciones que mejoren la función endotelial, incluido el tratamiento hipolipemiante, el tratamiento antioxidante, la inhibición de la enzima de conversión de la angiotensina (IECA) o el bloqueo del receptor de angiotensina II, son igual de eficaces como dejar de fumar, realizar EF y modificar las conductas nutricionales64. A nivel bioquímico, el EF incrementa el flujo sanguíneo y aumenta la tensión de roce o fricción de la sangre en el endotelio, estimulando precursores como L-arginina y enzimas mediadoras (por ejemplo eNOS) de la producción del NO65, lo cual favorece la vasodilatación. Esto se ha demostrado mediante correlaciones entre EF regular y aumento del diámetro de arteria coronaria66 en modelos animales67 y correlación con intensidad del EF y función enzimática oxidativa68 (fig. 4).
Fig. 4. Efectos del ejercicio físico aeróbico sobre la vasodilatación y el metabolismo oxidativo. La contracción muscular induce la producción de guanosín monofosfato cíclico (GMPc) a través del aumento de los valores de la óxido nítrico (NO) sintasa endotelial (eNOS) en el lecho vascular produciendo vasodilatación. Genes nucleares implicados en la biogénesis mitocondrial, incluidos el PGC-1α y el SIRT-1 como consecuencia del ejercicio físico, mejoran el metabolismo y la oxidación de lípidos implicados en la disfunción endotelial. PGC-1α: coactivador-1-alfa del receptor gamma activado por el proliferador de peroxisomas. SIRT-1: sirtuina 1.
Otros hallazgos son el aumento de metabolitos estables del NO (nitritos y nitratos)69 y guanosín monofosfato cíclico (GMPc) (segundo mensajero del NO)70 en individuos físicamente activos comparados con sedentarios. En las investigaciones que han evaluado el cambio de la función endotelial por el EF, mediante técnicas no invasivas, como la VMF71, en la que se mide el diámetro de la arteria después de hiperemia reactiva para cuantificar la capacidad de vasodilatación antes y después del EF, se han encontrado incrementos significativos, acompañados de cambios en la función metabólica72. Como se mencionó anteriormente, una reducción en la VMF manifiesta una condición patológica denominada DE, que puede presentarse como una respuesta disminuida al NO o una disminución en la producción de éste; por dicho motivo, la activación de la guanilato ciclasa por esta vía se encuentra reducida y la producción de GMPc, alterada73. Varios autores han demostrado que el EF regular tiene un efecto protector en la disminución de la VMF, restaurando los niveles previos en varones de mediana edad y mayores sedentarios74, y cuando se compara a varones aeróbicamente entrenados y varones sedentarios, los primeros presentan mejor VMF con relación a los sedentarios75. De esta manera, se indica que el EF mejora el índice de VMF en poblaciones sin enfermedades y en individuos con HTA y SM.
En militares con buena salud, Clarkson et al76 encontraron resultados positivos de un programa de 10 semanas de EF aeróbico y anaeróbico sobre la VMF, al estudiar a personas con HTA esencial sometidas a 12 semanas de EF aeróbico (30 minutos, 5 sesiones por semana) con intensidades entre el 50 y el 60% del VO2máx. Higashi et al77 encontraron un aumento significativo de la VMF en respuesta a la acetilcolina y al dinitrato de isosorbide (vasodilatador independiente del endotelio). En otro estudio con individuos con infarto agudo de miocardio y sometidos a 3 meses de EF aeróbico (en cicloergómetro) a intensidades del 75% de la frecuencia cardíaca pico de ejercicio, se demostró un aumento de la VMF78.
Al analizar el efecto de diferentes intensidades de EF aeróbico en las arterias coronarias, Goto et al79 verificaron que la intensidad moderada (50% del VO2máx) fue la única capaz de mejorar la VMF, comparada con el ejercicio de intensidad leve (25% del VO2máx) y/o de alta intensidad (75% del VO2máx). Sin embargo, los resultados de este trabajo contradicen lo reportado por otros autores del beneficio del EF en la función endotelial sistémica80.
A pesar de que varios estudios demostraron que el EF regular es la causa de la modificación del índice de la VMF, en ese contexto aparece una cuestión fundamental: ¿cuánto debe ser el VO2máx de entrenamiento que explica esas modificaciones? Lakka et al81 demostraron que unos valores mejores del VO2máx están relacionados con una progresión menor de enfermedad ateroesclerótica en varones. Rinder et al82 reportaron que en individuos mayores entrenados (68,5 años) comparados con individuos sedentarios (64,7 años), a medida que la capacidad aeróbica por VO2máx aumentaba, el diámetro arterial era igualmente mayor (r = 0,66, p < 0,002) durante el estado de hiperemia reactiva. Este efecto sólo pudo demostrarse en EF aeróbico a intensidades moderadas y no con entrenamiento de fuerza muscular.
Prescripción del ejercicio en la disfunción endotelial
Muchos pacientes con DE deben seguir las recomendaciones generales para la población sana, y considerar que la cantidad de EF debe ir aumentando de forma progresiva. La intensidad del EF puede ser de moderada a alta. El paciente deberá realizar actividades como caminar o trotar 20-30 km/semana.
Contraindicaciones
No hay evidencia de contraindicaciones absolutas, aunque en la prescripción del EF se deberá considerar las comorbilidades del paciente. Al igual que en pacientes con HTA o con enfermedad coronaria, los pacientes deberán abstenerse de practicar EF intenso (escala de Borg 15-16). Los pacientes con HTA deberán realizar entrenamiento de la fuerza con pesos ligeros (RM del 40 y el 70%).
Resistencia a la insulina y diabetes mellitus tipo 2
La insulina tiene una acción vasodilatadora específica en el músculo esquelético, mecanismo fundamental en el mantenimiento del tono vascular y en la modulación de la absorción de sustratos metabólicos83. Se ha demostrado que el efecto vasodilatador está mediado, en parte, por el efecto que ejerce la insulina en la expresión de la eNOS, (fig. 5). En individuos obesos que presentan RI y en diabetes mellitus, la producción y la biodisponibilidad del NO y la VMF se encuentran disminuidas entre el 40 y el 50% en relación con los controles sanos83. Asimismo, la respuesta vasodilatadora a la insulina también está deteriorada en estos pacientes84 y se ha informado de un incremento en citocinas proinflamatorias, como el TNF-α85.
Fig. 5. Mecanismo de acción de la insulina y su relación con el estado metabólico y vascular. eNOS: óxido nítrico sintasa endotelial; ET: endotelinas; GLUT4: transportador de glucosa 4; Grb: receptor del factor de crecimiento de unión a proteínas 2 (growth factor receptor boond protein 2); IRS: sustrato de receptor de insulina; MAO: monoamino oxidasa; PDK: piruvato deshidrogenasa kinasa; PI3-cinasa: fosfatidilinositol 3-cinasa; Ras/Raf: proteínas G pequeñas con propiedad de GTPasas; Shc: proteínas adaptadoras (SH2-containing domain); SOS: proteínas adaptadoras.
Prescripción del ejercicio en resistencia a la insulina y diabetes mellitus
A nivel metabólico, está claramente dilucidado el efecto del EF en la sensibilidad a la insulina (SI) y la vasodilatación dependiente de endotelio86. En parte, debido a la acción de la insulina que ocasiona vasodilatación fisiológica en el músculo esquelético87. Se sabe que el EF mejora la SI (determinado con el Homa Index) 88, lo cual contribuye de forma ostensible en la recuperación de la función endotelial, la perfusión periférica y la captación de glucosa89. En individuos con diabetes mellitus tipo 2, se produce un deterioro en los mecanismos de señalización dependientes de la insulina que regulan el transporte de glucosa al músculo esquelético. Es importante señalar que los mecanismos independientes de la insulina, como los que regulan la captación de glucosa a través del ejercicio/contracción, se mantienen indemnes (fig. 6).
Fig. 6. Modelo propuesto para las vías de señalización que intervienen en el transporte de glucosa en el músculo esquelético inducido por la insulina y por la contracción. En la vía de señalización de la insulina interviene la PI3-cinasa, mientras que puede haber múltiples vías que lleven al transporte de glucosa estimulado por la contracción. AMPK: proteincinasa activada por AMP; aPKC: proteincinasa C atípica; AS160: sustrato Akt de 160 kDa; CaMKII: proteincinasa II dependiente de Ca2+/calmodulina; CaMKK: proteincinasa cinasa dependiente de Ca2+/calmodulina; GLUT-4: transportador de glucosa 4; IRS-1/2: sustrato de receptor de insulina 1/2; PI3-cinasa: fosfatidilinositol 3 cinasa.
Nishida et al90 verificaron que 12 semanas de EF (60 min/día 5 veces por semana) mejoraron la SI en el músculo esquelético. Short et al91 constataron que 4 meses de EF aeróbico promovieron mejorías en la SI solamente en personas jóvenes, pero no en personas de mediana edad y mayores de edad. Aun así, se encontraron beneficios en todos los grupos etáreos en el contenido mitocondrial y su capacidad aeróbica. Asimismo, realizar EF de forma intensa induce una reacción inflamatoria. Esto se ha demostrado por el incremento de proteína C reactiva (PCR) y, por otro lado, hay además evidencia de que este incremento muestra una disminución gradual al realizar ejercicio de manera habitual92. Tomaszewski et al93 y Mattusch et al94 demostraron en pacientes sedentarios que, tras un período de EF aeróbico durante 9 meses, se reducía los niveles plasmáticos de PCR, comparado con un grupo control que no realizó ejercicio, lo cual indica el efecto antiinflamatorio del EF regular.
A nivel molecular, la contracción muscular inducida por el EF no tiene efecto alguno en el receptor de insulina, la fosforilación de sustrato de receptor de insulina 1 (IRS-1), ni en la actividad de fosfatidilinositol 3-cinasa (PI3-K)95. Este hallazgo lo demostraron autores como Lung et al96 y Lee et al97, los cuales, al suministrar un inhibidor de PI3-K, (wortmannina), no encontraron cambios en el transporte de glucosa estimulado por la contracción muscular. Estos datos ponen claramente de manifiesto que las señales de iniciación que conducen a una translocación de transportador de glucosa 4, por parte de la insulina y por parte del EF en el músculo esquelético, son diferentes. Entonces, el EF induce efectos indirectos en proteínas de la señal de la insulina como la proteincinasa activada por AMP, la proteincinasa dependiente de Ca2+/calmodulina y la proteincinasa C atípica, moléculas de señalización que intervienen en la captación de glucosa estimulada por la contracción muscular. Moléculas como la AS160 han surgido como el posible punto de convergencia a distancia en las cascadas de señalización de la insulina y del EF (fig. 6).
Prescripción del ejercicio en pacientes con resistencia a la insulina y diabetes mellitus
Muchos pacientes con RI o con inflamación son propensos a desarrollar complicaciones crónicas del aparato locomotor (por ejemplo, osteoartritis) o síntomas isquémicos (por ejemplo, angina de pecho). Por lo tanto, las recomendaciones para el ejercicio deben entregarse de manera individualizada, aunque la prescripción del EF podría mantener las recomendaciones poblacionales98. El objetivo de esta población es realizar EF por lo menos 30 minutos a intensidad moderada (12-13 según la escala de percepción de Borg, con breves incrementos a intensidades altas entre 15 y 16, según la escala de Borg) diarios. En estos pacientes también podrían incluirse actividades que acumulen 3-4 h/semana, como caminatas a paso ligero, trote, natación.
En pacientes con diabetes mellitus tipo 2, el EF deberá incluir algunas precauciones especiales, por ejemplo en los tratados con sulfonilureas (medicamentos orales indicados en el tratamiento de la diabetes mellitus tipo 2) o reguladores de la insulina posprandial, dado sus efectos hipoglucemiantes. Las precauciones incluyen el seguimiento de glucosa en sangre, la modificación de la dieta y el ajuste de la dosis de insulina. Con el fin de prevenir la hipoglucemia, 30 minutos antes del EF se deberán consumir 10-15 g de hidratos de carbono, siempre y cuando la glucosa sanguínea se encuentre en los niveles recomendados como seguros (< 200 mg/dl). Durante el EF prolongado, cada 30 minutos de EF deberán consumirse 10-20 g de hidratos de carbono como refrigerio (frutas, jugo o un refresco).
Al comenzar un programa de EF, los pacientes deberán medir su glucosa en sangre antes y después de la sesión de entrenamiento para aprender su respuesta individual a una determinada cantidad de EF. No obstante, si la hipoglucemia persiste, el especialista en ejercicio tendrá que considerar y valorar la dosis de insulina o de antidiabéticos orales. Se deberá recomendar que la insulina se suministre en una región muscular que no se encuentre activa durante el entrenamiento99. No se recomienda la administración de insulina o un análogo de acción rápida durante la realización del entrenamiento físico100.
Otros pacientes con diabetes mellitus tipo 2 desarrollan complicaciones crónicas del sistema locomotor (por ejemplo, osteoartritis). Si hay sintomatología, como neuropatía diabética, se recomienda calzado especial antes de comenzar con el EF formal. Por lo tanto, las recomendaciones deberían individualizarse, pero los ejercicios de resistencia y acondicionamiento de la fuerza muscular deberán incluirse, ya sea en combinación o por separado. Se sugiere que el EF sea individualizado, aunque en general, e objetivo en esta población será realizar, durante por lo menos 30 minutos, EF de intensidad moderada (12-13 según la escala de percepción de Borg, con incrementos breves a intensidades de 15-16 según Borg) diarios o 3,4 h/semana, mediante caminatas a paso ligero, montar en bicicleta, trotar, nadar, etc. Se ha encontrado que el entrenamiento físico de alta intensidad probablemente tenga efectos beneficiosos, pero hay que esperar los resultados de estudios que puedan determinar la importancia de la cantidad e intensidad del EF vigoroso. Se debe prestar atención en la presencia de neuropatía autónoma, según la puntuación en la escala de Borg, en contraste con el ritmo cardíaco. El entrenamiento de la fuerza muscular estará acondicionado a muchas repeticiones. Todo programa deberá incluir 5-10 minutos de calentamiento, 5-10 minutos de enfriamiento y una ingesta de hidratos de carbono.
Contraindicaciones
En términos generales, el peligro estará asociado más a la ausencia de EF. Si la glucosa en sangre está por encima de 417 mmol/l, el EF no podrá iniciarse hasta que se corrija la glucemia. Los pacientes con HTA y con retinopatía proliferativa activa deberán abstenerse de EF de alta intensidad, por la posibilidad de hacer maniobras de Valsalva. Los pacientes con HTA deberán realizar entrenamiento de fuerza (< 60 de la RM).
Si hay sospecha de pacientes que en reposo experimenten taquicardia, ortostatismo y termorregulación pobre, el EF deberá realizarse de manera controlada con seguimiento continuo del electrocardiograma, previa valoración con gammagrafía miocárdica y controlado por un cardiólogo. Todos los pacientes deberán ser instruidos para evitar practicar EF en ambientes fríos o con temperaturas muy cálidas, para garantizar una hidratación adecuada durante el EF, los pacientes con enfermedad coronaria deberán abstenerse de practicar EF intenso (Borg 15-16). Los pacientes con RI o diabetes mellitus tipo 2 deberán realizar entrenamiento de fuerza con pesos ligeros, previo test de valoración muscular (RM entre el 40 y el 60%).
Conclusión
En síntesis, se podría plantear que las alteraciones metabólicas relacionadas con obesidad abdominal, HTA, dislipidemia y resistencia a la insulina (factores de riesgo cardiovascular y componentes definitorios del SM), así como la DE (importante predictor temprano de enfermedad cardiovascular), podrían modularse de forma positiva mediante intervenciones correctamente planificadas de EF. Asimismo, el uso de un programa de EF puede tener contraindicación en algunas de las situaciones patológicas específicas; por ello, se aconseja la prescripción del EF de forma individual, considerando aspectos como la intensidad, la frecuencia, la duración, la modalidad, etc., y deberá realizarlo un profesional del área de las ciencias del deporte.
Correspondencia:
R. Ramírez-Vélez.
ICESI University.
Calle 18 No. 122-135.
Cali, Colombia.
Correo electrónico:
rebin640@hotmail.com
Historia del artículo:
Recibido el 2 de marzo de 2011
Aceptado el 15 de agosto de 2011